题目内容
【题目】电导率可用于衡量电解质溶液导电能力的大小。室温下,用0.100 mol·L-1 NH3·H2O滴定10 mL浓度均为0.100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。
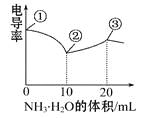
下列说法正确的是
A.①溶液中c(H+)为0.200 mol·L-1
B.溶液温度高低为①>③>②
C.③点溶液中有c(Cl-)>c(CH3COO-)
D.③点后因离子数目减少使电导率略降低
【答案】C
【解析】
A、醋酸是弱酸,不能根据醋酸的浓度来确定氢离子的浓度,错误;
B、酸碱中和反应是放热反应,所以反应未开始时的温度一定不是最高的,该反应过程可以认为开始的10mL氨水与盐酸反应,反应放热,后10mL氨水与醋酸反应,而醋酸电离是吸热的,所以氨水与醋酸反应放出的热量低于与盐酸反应放出的热量,所以②最高,错误;
C、③点时氨水与混酸完全反应生成氯化铵和醋酸铵,因为醋酸根离子水解,而氯离子不水解,所以c(Cl—)>c(CH3COO-),正确;
D、③点离子数目增大,但离子浓度减小,所以电导率降低,错误,答案选C。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目