题目内容
【题目】关于下列图像的叙述,正确的是
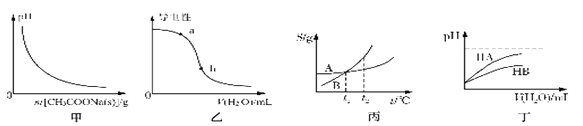
A. 图甲表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH 的变化
B. 图乙表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH: a>b
C. 图丙表示A、B两物质的溶解度随温度变化情况,将A、B 饱和溶液分别由t1℃升温至t2℃ 时,溶质的质量分数A=B
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
【答案】C
【解析】A.CH3COOH溶液加入少量CH3COONa晶体时醋酸的电离平衡向逆反应方向移动,氢离子浓度减小,溶液的pH增加,故A错误;B.加水稀释后溶液的酸性减弱,b点氢离子浓度小于a点氢离子的浓度,所以CH3COOH溶液的pH:a<b,故B错误;C、将A、B饱和溶液分别由t1℃升温至t2℃时两溶液中溶质和溶剂的量都不会改变,而二者t1℃溶解度相同,即浓度相同,所以t2℃时溶质的质量分数相等,故C正确;D、常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化可知酸性HA大于HB,NaB溶液中B水解程度大,产生OH-浓度大,pH大,故D错误;故选C。

 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是 ( )
A. 该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c(CH3OH)
B. 此时正、逆反应速率的大小:v正<v逆
C. 若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1
D. 0~10min内平均反应速率v(CH3OH)=1.6 mol·(L·min)-1
【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:① KMnO4/H+ ② NaOH溶液 ③ 饱和Na2CO3溶液 ④ H2O
⑤ Na ⑥ Br2/H2O ⑦ Br2/CCl4
Ⅱ.装置:
选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ① | ③ |
A. A B. B C. C D. D
【题目】锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量SiO2)制备锑白的两种工艺如下:
I.火法制取锑白,是将辉锑矿装入氧化炉的坩埚中,高温使其熔化后通入空气,充分反应后,经冷却生成锑白。写出火法制取锑白的化学方程式:________________________________________。
Ⅱ. 湿法制取锑白的工艺流程如图:

已知:
①Sb3+与Fe2+的氧化性强弱相当
②常温下:
化合物 | Fe(OH)2 | Fe(OH)3 | Sb(OH)3 |
Ksp近似值 | 8×10-16 | 4×10-26 | 4×10-42 |
③Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
④水解时保持溶液的c(H+)=0.1~0.3mol/L
(1)浸出是将辉锑矿溶于FeCl3溶液,请写出其中发生的氧化还原反应离子方程式_____________________________________________。滤渣的成分为______________________。
(2)采用铁粉作为还原剂进行还原,其目的是除去溶液中的离子___________(填离子符号),还原反应结束后,可用______________溶液来检验还原是否彻底。
(3)SbCl2是无色晶体,100升华,分子中所有原子都达到8e-稳定结构,请写出SbCl2的电子式____________________。
水解是利用SbCl2的水解反应制取Sb2O3(SbCl2的水解分为多步),其反应可以简单表示为:
SbCl3+3H2O![]() Sb(OH)2+3HCl,2Sb(OH)2=Sb2O3+3H2O
Sb(OH)2+3HCl,2Sb(OH)2=Sb2O3+3H2O
为了促进水解趋于完全,可采取的措施(填两点):_____________________
(4)简述检验沉淀是否洗净的实验方法:__________________________________________。
(5)若不加铁还原,则最终所得锑白的产率将_____________________(填“增大”、“减小”或“不变”)。
