题目内容
6.0.4mol/L Na2SO3溶液30mL与0.2mol/L K2R2O7溶液Y mL恰好反应,生成SO42-和R3+.Y值为( )| A. | 40 | B. | 30 | C. | 20 | D. | 10 |
分析 Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;K2R2O7溶液中R元素发生还原反应,化合价由+6价降低为+3价,根据电子转移守恒计算Y的值.
解答 解:根据电子转移守恒,则:
30×10-3L×0.4mol/L×(6-4)=Y×10-3L×0.2mol/L×2×(6-3),
解得Y=20,
故选C.
点评 本题考查氧化还原反应计算、氧化还原反应概念等,难度中等,表示出得失数目是解题关键,熟练掌握电子转移守恒思想的运用.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
20.下列说法中正确的是( )
| A. | 由C(s金刚石)=C(s石墨)△H=-1.19kJ/mol可知石墨比金刚石稳定 | |
| B. | 等质量的硫固体和硫蒸气分别完全燃烧,前者放出的热量多 | |
| C. | 热化学方程式中的化学计量数可以表示反映物质和生成物的微粒个数 | |
| D. | 2g H2完全燃烧生成液态水是将放出285.8kJ的热,则此反应的热化学方程式为2H2O(l)=2H2(g)+O2(l)△H=-285.8KJ/mol |
17.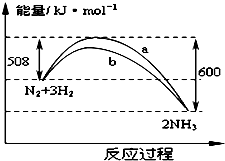 如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
 如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-1 | |
| B. | 一定条件下N2+3H2═2NH3达到平衡时,3v正(H2)=2v逆(NH3) | |
| C. | 加入催化剂,该反应的反应热发生改变 | |
| D. | 温度、容器体积一定,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ,则有184>Q2>2Q1 |
15.2009年8月15日~12月15日,公安部在全国开展为期四个月的严厉整治酒后驾驶交通违法行为专项行动,在执法中,交警用装有重铬酸钾[K2Cr2O7]的仪器检测司机是否酒后开车,因为酒中的乙醇分子可以使橙红色的重铬酸钾变成绿色的硫酸铬[Cr2(SO4)3].下列有关重铬酸钾的说法中正确的是( )
| A. | 铬元素的化合价为+7价 | B. | 在检查时重铬酸钾发生氧化反应 | ||
| C. | 重铬酸钾具有强氧化性 | D. | 它由橙红色变为绿色是物理变化 |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是(相对原子质量:C 12 H 1 O 16 )( )
| A. | 标准状况下,22.4L乙醇中含有的碳原子数目为2NA | |
| B. | 78g 苯含有碳碳双键的数目为3NA | |
| C. | 1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA | |
| D. | 28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |

 .
.