题目内容
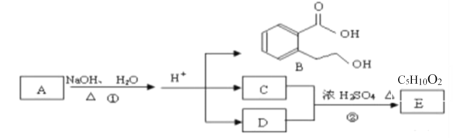
【题目】向![]() 时,体积均为20mL、浓度均为
时,体积均为20mL、浓度均为![]() 的两种酸HX、HY溶液中分別滴加
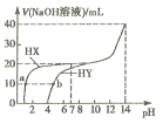
的两种酸HX、HY溶液中分別滴加![]() 的NaOH溶液,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是
的NaOH溶液,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是![]()
A.HX与NaOH溶液反应的离子方程式为:![]()
B.![]() 的数量级约为
的数量级约为![]()
C.b点时:![]()
D.![]() 时,两种反应后的溶液中
时,两种反应后的溶液中![]()
【答案】D
【解析】
A.由图可知,HX的pH等于1,则HX为强酸,所以HX发生反应的离子方程式为![]() ,故A错误;
,故A错误;
B.浓度为![]() 的HY,由图可知,HY的pH等于4,则
的HY,由图可知,HY的pH等于4,则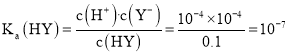 ,故B错误;
,故B错误;
C.b点为加入NaOH溶液体积为10mL,对于HY溶液中,反应恰好生成等量的HY和NaY,根据物料守恒:![]() ,故C错误;
,故C错误;
D.![]() 时,两种溶液恰好反应分别生成等量的NaX和NaY,NaY发生水解,所以溶液中
时,两种溶液恰好反应分别生成等量的NaX和NaY,NaY发生水解,所以溶液中![]() ,故D正确,
,故D正确,
故选:D。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验一如下(所取溶液体积均为10 mL):
实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
① | 25 | 0.1 | 0.1 |
② | 25 | 0.2 | 0.1 |
③ | 25 | 0.1 | 0.2 |
④ | 50 | 0.2 | 0.1 |
⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________对化学反应速率的影响。
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为______________________
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________(填字母序号)。
A.硫酸钾