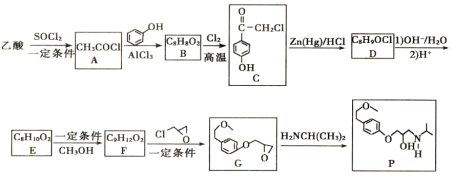
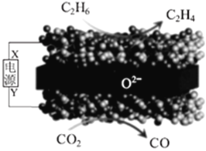
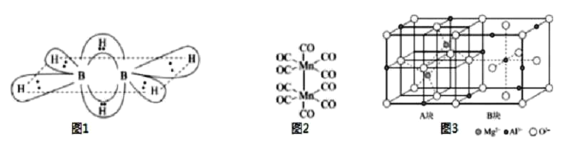
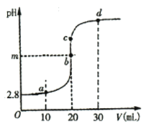
题目内容
【题目】下列说法中正确的是( )
A.22.4L CO2与足量Na2O2反应转移的电子数为NA
B.1mol·L-1的NaOH溶液中含Na+数目为NA
C.78gNa2O2晶体中含有的阴离子数目为2NA
D.a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加ag
【答案】D
【解析】
A、缺标准状况,无法计算22.4L CO2的物质的量,无法确定与足量Na2O2反应转移的电子数,故A错误;
B、缺溶液的体积,无法计算1mol·L-1的NaOH溶液中NaOH的物质的量,故B错误;
C、Na2O2晶体是由2个钠离子和1个过氧根离子组成的,78gNa2O2的物质的量为1mol,则1molNa2O2晶体中含有的阴离子数目为NA,故C错误;
D、2CO+O2![]() 2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2m(Na2CO3)-2m(Na2O2)=2m(CO),可知反应后固体质量增加量为CO的质量;2H2+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2m(Na2CO3)-2m(Na2O2)=2m(CO),可知反应后固体质量增加量为CO的质量;2H2+O2 ![]() 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2m(H2O)-m(O2)=2m(H2),则agCO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加ag,故D正确;
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2m(H2O)-m(O2)=2m(H2),则agCO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加ag,故D正确;
故选D。

 名校课堂系列答案
名校课堂系列答案【题目】工业上可用![]() 与
与![]() 合成亚硝酰氯
合成亚硝酰氯![]() ,可以用于有机合成。回答下列问题:
,可以用于有机合成。回答下列问题:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及有关反应的热化学方程式如下:
①![]()
②![]()
③![]()
则![]()
![]() __________(用
__________(用![]() 、
、![]() 表示)。
表示)。
(2)![]() 时,在一密闭容器中发生反应:
时,在一密闭容器中发生反应:![]() ,其正反应速率表达式
,其正反应速率表达式![]() 。测得正反应速率和对应浓度的数据如表:
。测得正反应速率和对应浓度的数据如表:
序号 |
|
|
① |
|
|
② |
|
|
③ |
|
|
则![]() __________达到平衡后,若减小压强,则混合气体的平均相对分子质量将__________(选填“增大”、“减小”或“不变”)。
__________达到平衡后,若减小压强,则混合气体的平均相对分子质量将__________(选填“增大”、“减小”或“不变”)。
(3)![]() 时,向体积为
时,向体积为![]() 且带气压计的恒容密闭容器中通入
且带气压计的恒容密闭容器中通入![]() 和
和![]() 发生反应:
发生反应:
![]() 。已知:反应起始和平衡时温度相同。
。已知:反应起始和平衡时温度相同。

①测得反应过程中压强![]() 随时间
随时间![]() 的变化如图1曲线
的变化如图1曲线![]() 所示,则
所示,则![]() __________(选填“>”、“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得压强
__________(选填“>”、“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得压强![]() 随时间
随时间![]() 的变化如图1曲线
的变化如图1曲线![]() 所示,则改变的条件是_________。
所示,则改变的条件是_________。
②图2是两位同学描绘的上述反应平衡常数的对数值![]() 与温度的变化关系图象,其中正确的曲线是______(选填“甲”或“乙”);
与温度的变化关系图象,其中正确的曲线是______(选填“甲”或“乙”);![]() 的值为______。
的值为______。
【题目】依据信息写出下列反应的方程式或填充合适的物质。
⑴氢氧化铟[In(OH)3]广泛应用于电子行业。以氧化铟废渣(主要含In2O3和Fe3O4)为原料制备氢氧化铟的一种工艺流程如下:
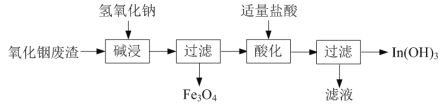
已知:In2O3为两性氧化物,在强碱性条件下In元素以InO33-离子形式存在。
①写出“碱浸”时反应的离子方程式:______。
②写出“酸化”时反应的离子方程式:______。
⑵下表所示为部分酸的电离平衡常数:
酸 | H2SO3 | CH3COOH | HCOOH |
电离平衡常数 | Ka1=1.2×10-2 Ka2=5.6×10-8 | 1.75×10-5 | 1.8×10-4 |
从H2SO3、CH3COOH中选择合适的物质,以实现HCOONa→HCOOH的转化,写出该反应的离子方程式:______。
⑶下表所示为部分物质的溶度积常数:
难溶物 | Mn(OH)2 | Co(OH)2 | MnCO3 |
溶度积常数 | 2×10-13 | 5.9×10-15 | 2.2×10-11 |
①从NaOH、Co(OH)2中选取合适的物质,填在如下转化关系中:MnCl2→Mn(OH)2。______
②NaNO3、Na2CO3中选择合适的物质,填在如下转化关系中:MnCl2→NaCl。_______