题目内容
【题目】B、C、N、Mg、Al、Si均是重要短周期元素,其化合物在工业中有重要用途。请回答下列问题:
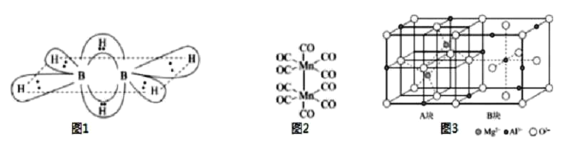
(1)硼氢化合物B2H6的结构如图所示,则B原子的杂化方式为___。2个硼原子与4个氢原子形成普通的σ键。这四个σ键在同一平面上,另外两个氢原子和这两个硼原子形成了两个垂直于该平面的“氢桥键”,该“氢桥键”为___中心___(原子)电子键(填阿拉伯数字)。
(2)CF4和PF3的沸点比较CF4___PF3(选填“>”或“<”)。PCl5中P原子采用sp3d杂化,形成三角双锥结构,而N原子只能形成NCl3,不能形成NCl5的原因是___。
(3)基态Mn原子核外特征电子排布式为___;已知CO的结构为C![]() O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___。
O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___。
(4)环状基型硅酸盐中硅氧四面体共角氧相连,并封闭成环,分单层环与双层环两大类,双层三环Si6O15,双层四环Si8O20、双层六环Si12O30、双层n环Si2nOm,当n=10时,m=___。
(5)尖晶石的结构如图3所示,请写出尖晶石的化学式___;A块、B块均为边长为apm的立方体,设阿伏伽德罗常数的值为NA,最近两个Al3+之间的距离为___pm,尖晶石的密度为___g/cm3(列出计算式)。
【答案】sp3 3 2 < N原子最外层无d轨道,不能发生sp3d杂化,不能形成NCl5 3d54s2 2:1 50 MgAl2O4 ![]() a
a ![]()
【解析】
根据化合物结构及共价键结构,判断原子杂化类型;分子晶体,根据相对分子质量比较沸点;根据元素周期表位置书写核外电子排布式;根据晶胞密度公式进行计算。
(1)硼氢化合物B2H6的结构如图,则B原子的杂化方式为sp3。2个硼原子与4个氢原子形成普通的σ键。这四个σ键在同一平面上,另外两个氢原子和这两个硼原子形成了两个垂直于该平面的“氢桥键”,该“氢桥键”为3中心2(原子)电子键。
(2) 对于分子晶体,相对分子质量越大,熔沸点越高,CF4和PF3的沸点比较CF4<PF3。PCl5中P原子采用sp3d杂化,形成三角双锥结构,而N原子只能形成NCl3,不能形成NCl5的原因是N原子最外层无d轨道,不能发生sp3d杂化,不能形成NCl5。
(3)锰原子序数为25,基态Mn原子核外特征电子排布式为3d54s2;已知CO的结构为C![]() O,三键中含有1个σ键和2个π键,锰原子和碳原子形成配位键,Mn2(CO)10中π键与配位键的个数比为2:1。
O,三键中含有1个σ键和2个π键,锰原子和碳原子形成配位键,Mn2(CO)10中π键与配位键的个数比为2:1。
(4)环状基型硅酸盐中硅氧四面体共角氧相连,并封闭成环,分单层环与双层环两大类,双层三环Si6O15,双层四环Si8O20、双层六环Si12O30,根据规律,双层n环Si2nOm,当n=10时,m=![]() =50。
=50。
(5)由尖晶石的结构可知,结构中氧离子作面心立方最紧密堆积,镁离子填充在四面体空隙,铝离子占据八面体空隙,晶胞中有8个分子,尖晶石的化学式MgAl2O4;A块、B块均为边长为apm的立方体,A块显示镁离子占据四面体空隙情况,B块表示铝离子占据四面体空隙情况,设阿伏伽德罗常数的值为NA,最近两个Al3+之间的距离为![]() a pm,尖晶石的密度为
a pm,尖晶石的密度为![]() g/cm3。
g/cm3。

【题目】如图所示测定溶液导电性实验的装置,甲与乙中盛有浓度相同的不同液体。接通电源后将甲中液体逐滴滴入乙中,发现灯泡由亮→暗灭→亮。下表中甲、乙所盛液体符合要求的是( )

选项 | 甲 | 乙 |
A | 氯化钠溶液 | 硝酸银溶液 |
B | 氨水 | 醋酸 |
C | 稀盐酸 | 碳酸钙悬浊液 |
D | 硫酸铜溶液 | 氢氧化钡溶液 |
A.AB.BC.CD.D
【题目】下列根据实验操作及现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 测定等浓度的 | 前者pH比后者大 | 非金属性:S>C |
B | 将NaCl晶体分散在乙醇中,用激光笔照射 | 出现光亮的通路 | 该分散系为胶体 |
C | 向溶液中加入盐酸酸化的 | 产生白色沉淀 | 溶液中含有 |
D | 向填充有经硫酸处理的 | 固体由橙色变为绿色 | 乙醇具有氧化性 |
A.AB.BC.CD.D