��Ŀ����
����Ŀ������������Դ������̼���ŷţ�ʵʩ��̼�����ǽ��������������
(1)���д�ʩ��������Ч���ٶ�����̼�ŷŵ���________��
A.ֲ�����֣�����ɭ�֣�����ֲ��
B.�Ӵ��ú��ʯ�͵Ŀ��ɣ�������ʹ��ʯ��Һ����
C.�ƹ�ʹ�ý��ܵƺͽ��ܵ�����ʹ�ÿյ�ʱ�ļ��¶Ȳ������ù��ͣ����첻�˹���
D.��������ʱ�ಽ�к������г��������ִ�������Ϣϵͳ���������乤�߿�ʻ��
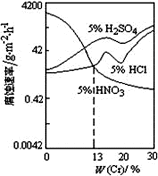
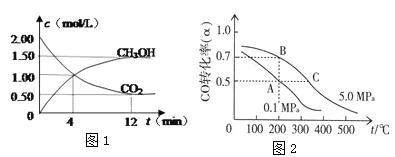
(2)CO2�ϳ�����ȼ�ϼ״�(CH3OH)��̼���ŵ��·���������ʵ�飺ij�¶�����1 L���ܱ������У���2 mol CO2��6 mol H2��������CO2(g)+3H2(g )![]() CH3OH(g)+H2O(g)���ֲ��CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ1��ʾ���ӷ�Ӧ��ʼ��ƽ��ʱCO2��ת����Ϊ_________��������ƽ����Ӧ����v(H2)=_______mol/(L��min)�����¶��µ�ƽ�ⳣ��Ϊ________��
CH3OH(g)+H2O(g)���ֲ��CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ1��ʾ���ӷ�Ӧ��ʼ��ƽ��ʱCO2��ת����Ϊ_________��������ƽ����Ӧ����v(H2)=_______mol/(L��min)�����¶��µ�ƽ�ⳣ��Ϊ________��
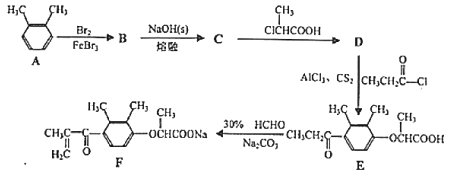
(3)CO�ڴ����������ɼ״���CO(g)+2H2(g)![]() CH3OH(g)����֪�ܱ������г���10 mol CO��20 mol H2��CO��ƽ��ת����(��)���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CH3OH(g)����֪�ܱ������г���10 mol CO��20 mol H2��CO��ƽ��ת����(��)���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
�ٸ÷�Ӧ����H_____0����S____0�� (����>��=��<��)
����A��C���㶼��ʾ�ﵽ��ƽ��״̬�����Է�Ӧ��ʼ����ƽ��״̬�����ʱ��tA ____ tC(����>��=��<��)
��A��B��C�����Ӧ��ƽ�ⳣ���ֱ�ΪKA��KB��KC����Ĵ�С��ϵ��____��
���𰸡�B 75% 0.375 1.33 < < > KA=KB>KC
��������
(1)A.ֲ�����ֱ���ɭ�֣�����ֲ��������ǿ������ã��������Ķ�����̼��
B.�Ӵ��ú��ʯ�͵Ŀ��ɣ�������ʹ��ʯ��Һ�����������Ӷ�����̼���ŷţ�
C.�ƹ�ʹ�ý��ܵƺͽ��ܵ�����ʹ�ÿյ�ʱ�ļ��¶Ȳ������ù��ͣ����첻�˹��ߣ���Լ�õ硢���������Խ��ܼ��ţ�
D.��������ʱ�ಽ�к������г��������ִ�������Ϣϵͳ���������乤�߿�ʻ�ʣ����Լ��ٷ������ŷźͽ�Լ��Դ��
(2)����ת����=![]() ��100%���㣻���ݷ�Ӧ���ĵ�H2��CO2�ķ�Ӧ���Ĺ�ϵ����H2ת�������ٸ��ݷ�Ӧ���ʵĶ���ʽ����v(H2)���ȼ���������ʵ�ƽ��Ũ�ȣ�Ȼ�����ƽ�ⳣ���ĺ������ƽ�ⳣ����
��100%���㣻���ݷ�Ӧ���ĵ�H2��CO2�ķ�Ӧ���Ĺ�ϵ����H2ת�������ٸ��ݷ�Ӧ���ʵĶ���ʽ����v(H2)���ȼ���������ʵ�ƽ��Ũ�ȣ�Ȼ�����ƽ�ⳣ���ĺ������ƽ�ⳣ����
(3)�ٸ���ͼ1֪�������¶�COת���ʽ��ͣ��жϷ�Ӧ����ЧӦ�����÷�Ӧ�����������������С�жϡ�S��С��
���¶�Խ�ߣ���ѧ��Ӧ����Խ�죬��Ӧ�ﵽƽ���ʱ��Խ�̣�
�ۻ�ѧƽ�ⳣ��ֻ���¶��йأ������¶ȶԻ�ѧƽ���ƶ���Ӱ�죬���ƽ�ⳣ���ĺ��弰A��B��C������¶��ж�KA��KB��KC��С��
(1)A.ֲ�����֣�����ɭ�֣�����ֲ��������ǿ������ã��������Ķ�����̼�����������⣬A����
B.�Ӵ��ú��ʯ�͵Ŀ��ɣ�������ʹ��ʯ��Һ�����������Ӷ�����̼���ŷţ��������⣬B��ȷ��
C.�ƹ�ʹ�ý��ܵƺͽ��ܵ�����ʹ�ÿյ�ʱ�ļ��¶Ȳ������ù��ͣ����첻�˹��ߣ��ܼ��ٵ��ʹ�ã�����ú��ʯ�ͻ�ʯȼ�ϵ�ʹ�ã����ٶ�����̼���ŷţ����������⣬C����
D.��������ʱ�ಽ�к������г��������ִ�������Ϣϵͳ���������乤�߿�ʻ�ʣ�����ʯ�ͻ�ʯȼ�ϵ�ʹ�ã����Լ��ٷ������ŷźͽ�Լ��Դ�����������⣬D����
�ʺ���ѡ����B��
(2)����ͼ���֪��CO2�ӷ�Ӧ��ʼ��ƽ�⣬CO2�ı�Ũ��Ϊ1.50mol/L����ʼŨ��Ϊ2.00mol/L�����CO2��ת����Ϊ![]() ��100%=75%��
��100%=75%��
���ݷ���ʽCO2(g)+3H2(g )![]() CH3OH(g)+H2O(g)��֪��ÿ��Ӧ����1molCO2����ͬʱ��Ӧ����3molH2����ӷ�Ӧ��ʼ��ƽ��CO2�ı�Ũ��Ϊ1.50mol/L����H2�ı�Ũ��Ϊ3��1.5mol/L=4.5mol/L����Ӧʱ��Ϊ12min��������H2��ʾ�ķ�Ӧ����Ϊv(H2)= 4.5mol/L��12min=0.375mol/(L��min)��
CH3OH(g)+H2O(g)��֪��ÿ��Ӧ����1molCO2����ͬʱ��Ӧ����3molH2����ӷ�Ӧ��ʼ��ƽ��CO2�ı�Ũ��Ϊ1.50mol/L����H2�ı�Ũ��Ϊ3��1.5mol/L=4.5mol/L����Ӧʱ��Ϊ12min��������H2��ʾ�ķ�Ӧ����Ϊv(H2)= 4.5mol/L��12min=0.375mol/(L��min)��
��Ӧ�ﵽƽ��ʱ���������ʵ�Ũ�ȷֱ���c(CO2)=0.50mol/L��c(H2)=1.50mol/L��c(CH3OH)=c(H2O)=1.50mol/L�����Ը÷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() =1.33��
=1.33��
(3)�ٸ���ͼ1��֪�������¶�COת���ʽ��ͣ�˵�������¶ȣ�ƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ����÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����ԡ�H<0�����ݷ���ʽCO(g)+2H2(g)![]() CH3OH(g)��֪���÷�Ӧ������Ӧ�����������С�ķ�Ӧ�����ԡ�S<0��
CH3OH(g)��֪���÷�Ӧ������Ӧ�����������С�ķ�Ӧ�����ԡ�S<0��
���¶�Խ�ߣ���ѧ��Ӧ����Խ�죬��Ӧ�ﵽƽ���ʱ��Խ�̣������¶�A<C����ѧ��Ӧ����A<C����Ӧ����Խ�죬��Ӧ�ﵽƽ��ʱ���Խ�̣����Է�Ӧʱ��A>C�����Է�Ӧ��ʼ������ƽ��״̬�����ʱ��tA����tC��
�۸��ݢٿ�֪�÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ����H<0�����ͼ����ʾ��֪�¶ȣ�A=B<C�������¶ȣ���ѧƽ�������ƶ�����ѧƽ�ⳣ����С�����Ի�ѧƽ�ⳣ��KA��KB��KC����Ĵ�С��ϵ��KA=KB>KC��

 ��У����ϵ�д�
��У����ϵ�д�