题目内容
a1和a2分别为A在两个恒容容器中平衡体系A(g) 2B(g) 和2A(g)
2B(g) 和2A(g) B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
 2B(g) 和2A(g)
2B(g) 和2A(g) B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )| A.a1、a2均减小 | B.a1、a2均增大 |
| C.a1增大,a2减小 | D.a1减小,a2增大 |
D
试题分析:恒容容器中增加A的物质的量相当于对体积加压,对于第一个反应平衡逆向移动,a1减小,对于第二个反应平衡正向移动,a2增大。答案选D。
点评:对于只有一种反应物的反应,改变反应物的量相当于加压,平衡向哪个方向动不能确定,要有方程式的计量系数决定。

练习册系列答案
相关题目
 2NH3,在反应起始时N2和H2分别为1mol和3mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同,则NH3的起始的物质的量和它的转化率为
2NH3,在反应起始时N2和H2分别为1mol和3mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同,则NH3的起始的物质的量和它的转化率为  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol

 2C(g)+4D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=1.21V L。请回答:
2C(g)+4D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=1.21V L。请回答:
 CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
 pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是( )
pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是( ) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
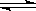 zC
zC