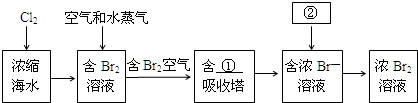
题目内容
5.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 0.1 mol•L-1CH3COOH溶液中含有0.1NA个CH3COO- | |
| C. | 常温常压下,8gO2含有4NA个电子 | |
| D. | 1molNa被完全氧化生成Na2O2,失去个2NA电子 |
分析 A、HCl溶于水后完全电离为氢离子和氯离子;
B、溶于体积不明确;
C、求出氧原子的物质的量,然后根据1mol氧原子中含8mol电子来分析;
D、根据反应后钠元素变为+1价来分析.
解答 解:A、HCl溶于水后完全电离为氢离子和氯离子,故盐酸溶液中无HCl分子,且盐酸为液体,不能根据气体摩尔体积来计算其物质的量,故A错误;
B、溶于体积不明确,故溶液中的醋酸根的个数不能计算,故B错误;
C、8g氧气中氧原子的物质的量n=$\frac{8g}{16g/mol}$=0.5mol,而1mol氧原子中含8mol电子,故0.5mol氧原子中含4mol电子即4NA个,故C正确;
D、由于反应后钠元素变为+1价,故1mol钠失去1mol电子即NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
15.下列说法或表示正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少 | |
| B. | 由单质A转化为单质B时△H=+119 kJ•mol-1可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 在101 kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2在101 kPa时的燃烧热为571.6 kJ•mol-1 |
13.下列变化中,必须要加入氧化剂才能实现的是( )
| A. | Na2O2→O2 | B. | FeCl2→FeCl3 | C. | HCl→H2 | D. | SO3→H2SO4 |
20.下列操作能达到实验目的是( )
| A. | 为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 | |
| B. | 在纯锌与稀硫酸的反应混合物中滴入少量Cu(NO3)2溶液后生成H2的反应速率加快 | |
| C. | 各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘上称量 | |
| D. | 用如图所示装置吸收氨气可防倒吸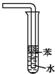 |
10.下列说法不正确的是( )
| A. | 常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≥V2 | |
| B. | Hg、Cu、Al可以分别用热分解法、热还原法和电解法冶炼 | |
| C. | 由两种活泼性不同金属构成的原电池两极中,一定是活泼性强的作负极 | |
| D. | 粗盐提纯中除去Mg2+时的离子方程式:Mg2++2OH-═Mg(OH)2↓ |
13.下列有关化学用语正确的是( )
| A. | 溴化钠的电子式: | B. | 氮气分子的结构式:N≡N | ||
| C. | 硫原子的结构示意图: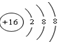 | D. | 氯化氢分子的电子式: |