��Ŀ����
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߡ��ش��������⣺
��1����Ԫ���������______��������ͬ�ĵ��ӣ���______���˶�״̬��ͬ�ĵ��ӣ�д�����������ӵĵ����Ų�ʽ__________________��
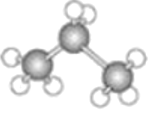
��2��![]() �Ŀռ乹�ͺ�
�Ŀռ乹�ͺ�![]() ��ͬ��д��
��ͬ��д��![]() �ĵ���ʽ��__________________��
�ĵ���ʽ��__________________��
��3�����ֶ�����Ԫ�ػ��ϼ���ԭ�������Ĺ�ϵ����ͼʾ��ʾ��

��Ԫ��X��Ԫ�����ڱ��е�λ����__________________��
��д��Ԫ��Y��Z������������Ӧˮ���ﷴӦ�����ӷ���ʽ��______________________________��
�۵�����������Ԫ���зǽ�������ǿ������Ԫ����____________��____________����Ԫ�ط��ţ�����һ����ѧ����ʽ˵��������Ԫ�طǽ����Ե����ǿ����______________________________��
��4������ͬ��Ԫ�ص�ԭ�����γɵļ������У���ԭ����������������____________����������ǿ����������____________��
��5��д������W�ĺ�����Ļ�ѧʽ____________��____________�����һ��ʵ�鷽���Ƚ������������ǿ����д����Ӧ�Ļ�ѧ����ʽ��________________________��
���𰸡�5 14 ![]()
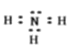 �ڶ����ڵ�VIA��
�ڶ����ڵ�VIA�� ![]() S Cl
S Cl ![]() Cl-
Cl- ![]()
![]()
![]()
![]()
��������
�Ź�ԭ�ӵĵ����Ų�ʽΪ![]() ������������ͬ�ĵ�����5�֣�ÿ�����ӵ��˶�״̬����ͬ���ж��ٵ��Ӿ��ж����˶�״̬��������14���˶�״̬��ͬ�ĵ��ӣ�������Ϊ����㣬�������������Ų�ʽΪ
������������ͬ�ĵ�����5�֣�ÿ�����ӵ��˶�״̬����ͬ���ж��ٵ��Ӿ��ж����˶�״̬��������14���˶�״̬��ͬ�ĵ��ӣ�������Ϊ����㣬�������������Ų�ʽΪ![]() ���ʴ�Ϊ��5��14��
���ʴ�Ϊ��5��14��![]() ��
��
��![]() �ĵ���ʽΪ�� :
�ĵ���ʽΪ�� :![]() :H���ʴ�Ϊ�� :
:H���ʴ�Ϊ�� :![]() :H��
:H��
��
��X�Ļ��ϼ�Ϊ-2�ۣ������ۣ���ΪOԪ�أ��ڵڶ����ڵ�VIA�壬�ʴ�Ϊ���ڶ����ڵ�VIA�壻
��Ԫ��Y��Z�ֱ�ΪNa��Al������������Ӧˮ����ΪNaOH��Al(OH)3�����ӷ�Ӧ����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��ͬһ�����У��������ҷǽ�����Խ��Խǿ��������ǿ������Ԫ��ΪS��Cl���ǽ�����ǿ��Ԫ�ص��ʿ����û��ǽ��������ĵ��ʣ����Ի�ѧ��Ӧ����ʽΪ![]() ���ʴ�Ϊ��S��Cl��
���ʴ�Ϊ��S��Cl��![]() ��
��
�ȵ��ʵ�������Խǿ����Ӧ���ӵĻ�ԭ��Խ�������ʵĻ�ԭ��Խǿ����Ӧ���ӵ�������Խ�������Ի�ԭ���������������������ӣ���������ǿ���������������ӣ��ʴ�Ϊ��Cl-��Al3+��
��WΪSԪ�أ�������ֱ�Ϊ![]() ��
��![]() ������ǿ���������ԭ������ѧ��Ӧ����ʽΪ��
������ǿ���������ԭ������ѧ��Ӧ����ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�