题目内容
某课外活动小组的学生用镁条与稀硫酸反应制取氢气并研究标准状况下1 mol氢气的体积。实验用品:
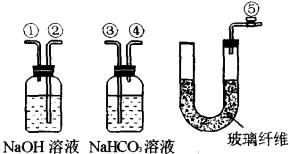
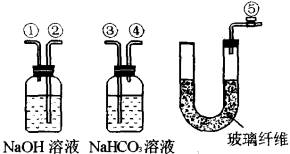
仪器:电子天平、砂纸、水槽、100 mL烧杯、铁架台、单孔橡皮塞(玻璃管上带橡胶管和止水夹)、铜丝、30 mL酸式滴定管、100 mL小口径测气管(见下图)。
![]()
药品:镁条、水、15 mol·L-1的浓硫酸。
(1)本实验用0.6 mol·L-1的硫酸进行反应,活动小组共需要480 mL该浓度的硫酸,写出用15 mol·L-1的浓硫酸配制0.6 mol·L-1的硫酸时,还用到的仪器名称和规格____________、____________、____________;需要15 mol·L-1的浓硫酸____________mL。
(2)选用上述仪器的药品进行实验,补写下列实验步骤:
①取一段镁条,擦去氧化膜,称量;
②用细铜丝包裹镁条,铜丝的另一端插在单孔橡皮塞(玻璃管上带橡胶管和止水夹)上;
③_____________________________________________________________;
④_____________________________________________________________;
⑤_____________________________________________________________;
⑥待镁条全部反应后,放置一段时间,调节测气管中水面高度,使管中水面与水槽中水面相平,读出氢气体积。
(3)问题讨论:
①在标准状况下,其他操作都正常,为了保证实验成功,取用的镁条质量应小于_________________g,所用的稀硫酸应大于_________________mL。
②在标准状况下,某学生进行了5次实验,将实验数据通过计算,结果如下:
实验序号 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
H2的体积(L·mol-1) | 23.45 | 22.41 | 22.38 | 22.39 | 22.42 |
则通过实验验证,标准状况下,1 mol H2的体积为____________L。
(1)500 mL容量瓶 胶头滴管 玻璃棒 20
(2)③向测气管中加入8 mL—10 mL 0.6 mol·L-1稀硫酸,再加水至满 ④将止水夹夹住橡胶管,把带镁条的橡胶塞塞上
⑤立即倒置于盛水的水槽中,打开止水夹
(3)①0.107 7.44 ②22.40(第一次实验数据误差太大,舍去!)
解析:该实验是用一定质量的Mg与足量H2SO4反应并测量生成的H2体积,用以计算气体的摩尔体积。最后实验数据中,应舍去第一组数据,再求其他各组数据的平均值。

 寒假创新型自主学习第三学期寒假衔接系列答案
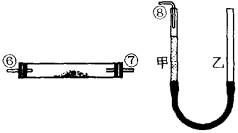
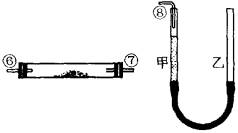
寒假创新型自主学习第三学期寒假衔接系列答案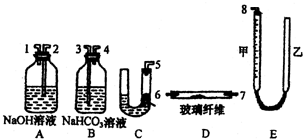 (实验化学)某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积.如图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水.甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低.
(实验化学)某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积.如图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水.甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低.