题目内容
【题目】硫化氢气体在资源利用和环境保护等方面均有重要应用。
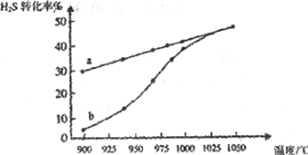
(1)工业上采用高温分解H2S制取氢气,2H2S(g)![]() 2H2(g)+S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g)+S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
①反应2H2S(g)![]() 2H2(g)+S2(g)的ΔH__(填“>”“<’或“=”)0。
2H2(g)+S2(g)的ΔH__(填“>”“<’或“=”)0。
②985℃时,反应经过5s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2)=__。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是__。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
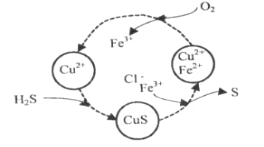
在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中尽可能不含CuS,可采取的措施有__。
【答案】> 0.04mol/(L·s) 温度升高,反应速率加快,达到平衡所需时间缩短 增加氧气的通入量或增加起始时c(Fe3+)
【解析】
(1)①根据温度升高,转化率增大,可知平衡正移,据此分析;
②根据转化率求出反应的量,再求反应速率;
③根据温度对速率的影响分析;
(2)①根据图中各元素化合价变化分析;
②欲使生成的硫单质中不含CuS,则硫离子不能剩余,硫离子完全被氧化为S单质,据此分析。
(1)①由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,故答案为:>;
②H2S的起始浓度均为1molL1,若985℃时,反应经5s达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为1mol×40%=0.4mol,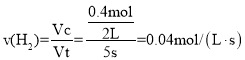 ,故答案为: 0.04mol/(L·s);
,故答案为: 0.04mol/(L·s);
③随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;故答案为:温度升高,反应速率加快,达到平衡所需时间缩短;
(2)欲使生成的硫单质中不含CuS,则硫离子不能剩余,即硫离子完全被氧化为S单质,所以氧气必须过量,采取的措施为提高混合气体中空气的比例;由图示可知Fe3+起到催化作用,所以增大c(Fe3+)也可以使得硫离子完全被氧化为S单质,故答案为:增加氧气的通入量或增加起始时c(Fe3+)。

【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D