题目内容
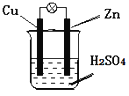
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为______(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是_____。(用化学式回答)
(3)由①、④、⑤三种元素形成化合物的电子式______ 。
(4)⑥的单质与NaOH溶液反应的离子方程式_______。
(5)⑦的氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1 g氢化物自燃放出45.0 kJ的热量(产物水为液态),其热化学方程式为_________。
(6)由表中元素形成的常见物质A、B、C、D、E、F转化关系如下图所示。已知:A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体, E的相对分子质量比D大17 ,D为红棕色气体(部分反应中生成物没有全部列出,反应条件未列出)
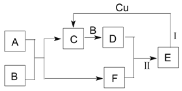
①A的结构式为_______。
②A和B反应生成C和F的化学方程式为_______,反应Ⅰ的离子方程式为________。
【答案】r(Na)>r(N)>r(O) HNO3>H2CO3>H2SiO3 ![]() 2Al + 2OH- + 2H2O = 2AlO2-+ 3H2↑ SiH4(g)+2O2(g)= SiO2(s)+2 H2 O(l) △H =-1440 kJ/mol
2Al + 2OH- + 2H2O = 2AlO2-+ 3H2↑ SiH4(g)+2O2(g)= SiO2(s)+2 H2 O(l) △H =-1440 kJ/mol ![]() 4NH3+5O2
4NH3+5O2 4NO+6H2O 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
4NO+6H2O 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素。
(1)电子层越多半径越大,所以钠大于氮和氧,氮和氧处于同周期,从左至右,半径减小,则r(N)>r(O),故③、④、⑤原子半径由大到小的顺序为r(Na)>r(N)>r(O);
答案为r(Na)>r(N)>r(O)。
(2)元素非金属性越强,其最高价氧化物对应水化物酸性越强,②、③、⑦,非金属性:N>C>Si,则最高价氧化物对应的水化物酸性由强到弱的顺序是:HNO3>H2CO3>H2SiO3;
答案为HNO3>H2CO3>H2SiO3。
(3)由①、④、⑤三种元素形成化合物是NaOH,则它的电子式为![]() ;
;
答案为![]() 。
。
(4)⑥的单质与NaOH溶液反应的离子方程式:2Al + 2OH- + 2H2O = 2AlO2-+ 3H2↑;
答案为2Al + 2OH- + 2H2O = 2AlO2-+ 3H2↑。
(5)1gSiH4自燃放出热量45.0 kJ,则1moSiH4即32gSiH4自燃放出热量为45.0 kJ×32=1440.0kJ,热化学方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H= -1440.0kJ/mol;
答案为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H= -1440.0kJ/mol。
(6)B是能使带火星的木条复燃的无色无味气体,则B是O2,D是红棕色气体,则D是NO2,E的相对分子质量比D大17 ,D的相对分子质量是46,则E的相对分子质量为63,则E为HNO3,A是常见气态氢化物,且能和氧气反应,所以根据图中的转化课判断,A是NH3,则C就是NO,F是水.NO和氧气反应生成NO2,NO2溶于水生成硝酸,硝酸和铜反应又生成NO;
①A的结构式为:![]() ;
;
答案为![]() 。
。
②A和B反应生成C和F的化学方程式为:4NH3+5O2=4NO+6H2O ,反应Ⅰ的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
答案4NH3+5O2 4NO+6H2O,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
4NO+6H2O,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。

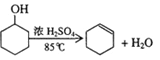
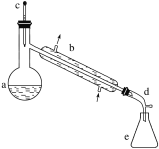
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
可能用到的有关数据如下:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________。
(2)加入碎瓷片的作用是_____________________________________________________;
如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________________________________。
(4)分液漏斗在使用前须清洗干净并_____;在本实验分离过程中,产物应该从分液漏斗的_____(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A.接收器 B.温度计 C.吸滤瓶 D.球形冷凝管
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
【题目】(下图为某植物的光合作用过程模式图,字母 A-G 表示物质或结构,二烷氨基乙醇羧酸脂(DA-6)是一种新型的叔胺类植物生长调节剂。某科研小组研究了 DA-6 对西瓜光合作用的影响,其相关指标测定(Rubisco 是碳反应的关键酶)结果如下表:

D A - 6 对西瓜光合作用的影响实验结果记录表
组 别 | 处理 | 光合速率 | 气孔导度 | 胞间二氧化碳浓度 | Rubisco 活性 |
(mmolm-2s-1) | (mmolm-2s-1) | (mmolm-2s-1) | (umolm-2s-1) | ||
① | 不遮光+清水 | 10.1 | 0.16 | 260 | 38.2 |
② | 不遮光+DA-6 | 15.2 | 0.24 | 255 | 42.1 |
③ | 遮光+清水 | 8.3 | 0.14 | 278 | 25.3 |
④ | 遮光+DA-6 | 13.4 | 0.23 | 269 | 35.7 |
(1)图中产生物质 A 的结构是___________________________,D 物质为___________________________。
(2)据图推测类囊体腔中积累H+的生理意义最可能是___________________________。
(3)突然停止光照,短期内三碳酸分子的含量将会___________________________。
(4)胞间 CO2 进入叶绿体内参与卡尔文循环,该过程生成 3 个 RuBP 需消耗___________________________个三碳糖磷酸,RuBP 的元素组成为__________________________。
(5)气孔导度表示气孔开放的程度。该研究能说明气孔导度不是遮光条件下光合速率下降的主要限制因素,可以证明此结论的实验组别是___________
A.① ② B.① ③ C.③ ④ D.② ④
(6)DA-6 可提高西瓜叶片的光合速率。从表数据进行推测,DA-6 提高西瓜叶片光合速率作用机制是:DA-6 通过__________________________,从而提高光合作用的速率。