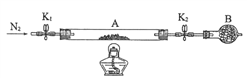
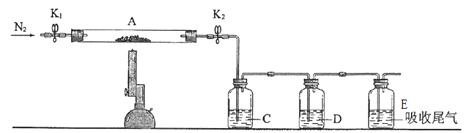
题目内容
【题目】在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10﹣2 mol/(Lmin)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10﹣2 mol/(Lmin)
C.反应到6 min时,H2O2分解了50%
D.反应到6 min时,c(H2O2)=0.30 mol/L
【答案】D
【解析】A.0~6min产生的氧气的物质的量n(O2)= ![]() =0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=
=0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)= ![]() mol/(Lmin)≈3.3×10﹣2 mol/(Lmin),A不符合题意;
mol/(Lmin)≈3.3×10﹣2 mol/(Lmin),A不符合题意;
B.反应物浓度越大反应速率越大,随着反应进行,反应速率逐渐减小,前6min内反应速率为3.3×10﹣2 mol/(Lmin),则6~10 min的平均反应速率:v(H2O2)<3.3×10﹣2 mol/(Lmin),B不符合题意;
C.6min产生的氧气的物质的量n(O2)= ![]() =0.001mol,n(H202)=2n(O2)=0.002mol,其分解率=
=0.001mol,n(H202)=2n(O2)=0.002mol,其分解率= ![]() ×100%=50%,C不符合题意;
×100%=50%,C不符合题意;
D.6min时,c(H2O2)=(0.40﹣ ![]() )mol/L=0.20mol/L,D符合题意;
)mol/L=0.20mol/L,D符合题意;
所以答案是:D.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.

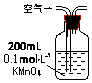
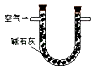
【题目】某兴趣小组甲设计了以下装置和方法测定空气中SO2含量.你认为可行的操作是
序号 | A | B | C |
装置 |
|
|
|
原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
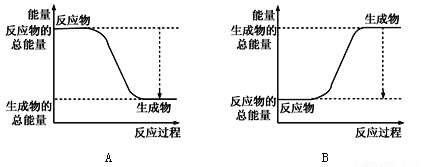
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:

①装置甲中SO![]() 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
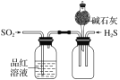
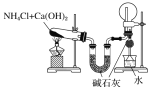
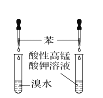
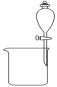
【题目】下列有关实验装置及实验方案的设计不正确的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验设计 | 探究SO2的氧化性和漂白性 | 实验室制氨气并收集干燥的氨气 | 验证苯中是否有碳碳双键 | 用乙醇提取溴水中的Br2 |
A. A B. B C. C D. D