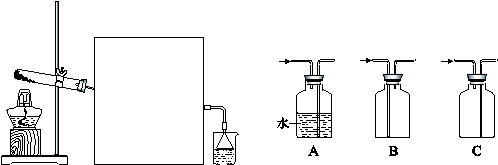题目内容
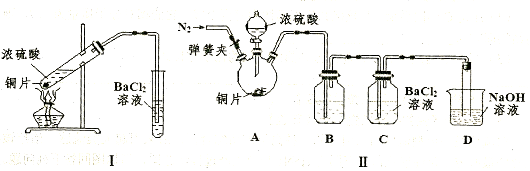
选用适当装置、试剂和方法可制备中学化学中的几种常见气体。请填写表中的空格(从①~⑩中选择,填序号):
| 实验 | 气体 | 所用装置 | 气体性质 | 干燥该气体选用的试剂 |
| (1) | | ③ | 其水溶液显碱性 | |
| (2) | | | 1mol最多能与2molH2反应 | ⑩ |
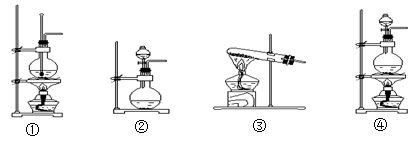
⑤Cl2 ⑥C2H2
⑦C2H4 ⑧NH3
⑨碱石灰 ⑩浓H2SO4
(每空1分,共4分)
(1)⑧、⑨
(2)⑥、②
解析试题分析:⑴从气体的性质为碱性气体得出该气体为氨气,选⑧,干燥剂只以选碱性干燥剂⑨碱石灰;⑵1mol最多能与2molH2反应,所提供的气体只有⑥C2H2,原料为电石和饱和食盐水,是固体和液体不加热,选用装置②。
考点:气体的制备

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
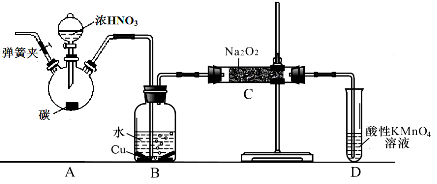
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)某兴趣小组采用如图所示装置制取SO2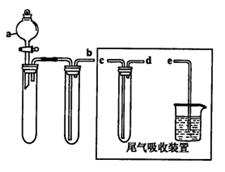
①下列实验方案适用如图所示装置制取所需SO2的试剂是_______(填序号)。
| A.Na2SO3溶液与稀硝酸 |
| B.Na2SO3固体与浓硫酸 |
| C.固体硫和氧气 |
| D.铜与浓硫酸 |
③尾气吸收装置的连接顺序是b接( )接 ( )接e。
(2)为了回收利用SO2废气,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体(
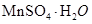 生产流程,其流程示意图如下:
生产流程,其流程示意图如下:
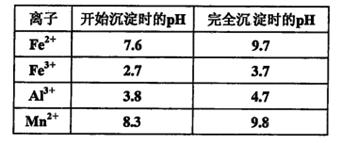
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
请回答:
①含Al3+的盐常用作净水剂,用离子方程式表示其净水原理________________________。
②浸出过程中主要反应的化学方程式是___________________________________________。
③氧化过程中加入MnO2粉的目的是______________________________________________;
反应的离子方程式是_________________________________________________________。
④用石灰浆调节pH,pH应调节的范围是___________________________________。
⑤滤渣的主要成分是____________________________________。
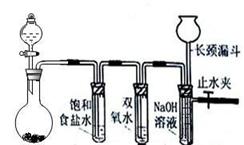
Ⅰ. 在实验室利用下列装置,可制备某些气体并验证其化学性质。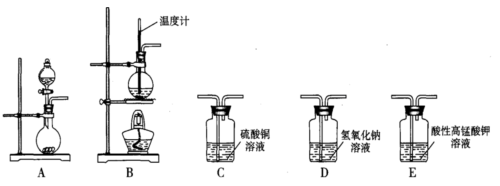
完成下列表格:
| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | _________________ | _________________ |
| (2) | 乙炔 | A→C→E | _________________ |
经查阅有关资料得知H2S、PH3能与硫酸铜溶液反应,相关仪器和药品装置图如下:
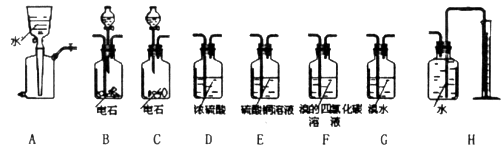
(1)按气体从左到右的流向选择最佳的装置组合是(选填字母序号):_________
(2)为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体是________________。
(3)若电石样品的质量为m1g,F吸收乙炔前后的质量差为m2g,则电石样品中CaC2质量分数
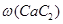 =_______________。
=_______________。 从下列事实所得出的相应结论正确的是( )
| 序号 | 实验事实 | 结论 |
| ① | Cl2的水溶液可以导电 | Cl2是电解质 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| ④ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
A.①② B.②④ C.①③ D.③④