��Ŀ����
����Ŀ�������仯������������������������Ҫ����;����֪�����������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ���������ˮ�����ɼ�ʽ�Ȼ�����(Sn(OH)Cl)��SnCl4����ˮ�⡣�밴Ҫ��ش�����������⣺
��1����ԭ�ӵĺ˵����Ϊ50������ԭ�ӽṹʾ��ͼΪ________________��
��2�� SnCl2��ĩ���Ũ��������ܽ⣬����ƽ���ƶ�ԭ������ԭ��____________��
SnCl4����������ˮ����Ũ��״�������������Ļ�����䷴Ӧ�Ļ�ѧ����ʽΪ______________��
��3����������(SnSO4)��һ����Ҫ�������Σ��㷺Ӧ���ڶ�����ҵ��ij�о�С�����SnSO4�Ʊ�·�����£�
�ٲ�������___________��
�ڼ���Sn�۵�������������a.������ҺpH�� b.__________.
�۷�Ӧ���õ�������SnO���õ��ó��������ӷ�Ӧ����ʽ��______________��
��4�����ۿ���������������������С��ͨ�����з����ⶨ�������۵Ĵ��ȣ����ʲ����뷴Ӧ����
�ٽ�1.2g�������������У������ķ�ӦΪ��Sn+2HCl=SnCl2+H2�����ڼ��������FeCl3������0.1 mol/L��K2Cr2O7�ζ����ɵ�Fe2+ (��֪���Ի����£�Cr2O72-�ɱ���ԭΪCr3+)������ȥK2Cr2O7��Һ32mL������������������������_____________��
���𰸡�  SnCl2+H2O=Sn(OH)Cl+HCl������������ʹ��ƽ�������ƶ�������Sn2+ˮ�� SnCl4+4NH3+4H2O=Sn(OH)4+4NH4C1 ����Ũ������ȴ�ᾧ�����ˡ�ϴ�������� ��ֹSn2+������ Sn2++CO32-=SnO��+CO2�� 95.2%
SnCl2+H2O=Sn(OH)Cl+HCl������������ʹ��ƽ�������ƶ�������Sn2+ˮ�� SnCl4+4NH3+4H2O=Sn(OH)4+4NH4C1 ����Ũ������ȴ�ᾧ�����ˡ�ϴ�������� ��ֹSn2+������ Sn2++CO32-=SnO��+CO2�� 95.2%
����������1����ԭ�ӵĺ˵����Ϊ50������ԭ�ӽṹʾ��ͼΪ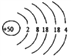 ��
��
��2�� SnCl2��ĩ���Ũ��������ܽ⣬ԭ��Ϊ�Ȼ���������ˮ����ˮ��ƽ����ڣ�SnCl2+H2O=Sn(OH)Cl+HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ����SnCl4����������ˮ����Ũ��״�������������Ļ������ԭ�����Ȼ�����ˮ������ˮ�����������������Ȼ��⣬�Ȼ�����ˮ���γɰ������Ȼ��������������Ȼ�麟��ְ��̣���Ӧ�Ļ�ѧ����ʽΪSnCl4+4NH3+4H2O=Sn(OH)4+4NH4C1��
��3�����Ʊ�·��������Ϣ��֪���Ȼ��������ܺ������ۣ�һ���������Һ������ԣ���һ������Է�ֹ�Ȼ����������������˺�����Һ�м���̼�������Ȼ�������Һ��Ӧ����SnO�����˵õ�SnO��Ưϴ��������Ὣ���ܽ�õ�����������Һ��������Һ����Ũ�������½ᾧ�����ˡ�ϴ�ӡ�����õ�����������
�ٲ������Ǽ���Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
�ڼ���Sn�۵�������������a.������ҺpH�� b. ��ֹSn2+��������.
�۷�Ӧ��õ�������SnO���õ��ó��������ӷ�Ӧ����ʽ��Sn2++CO32-=SnO��+CO2����
��4���ⶨ�������۵Ĵ��ȣ����ʲ����뷴Ӧ�����ٽ�1.2g�������������У������ķ�ӦΪ��Sn+2HCl=SnCl2+H2�����ڼ��������FeCl3������0.1 mol/L��K2Cr2O7�ζ����ɵ�Fe2+ (��֪���Ի����£�Cr2O72-�ɱ���ԭΪCr3+)������ȥK2Cr2O7��Һ32mL��������֪���Ȼ��������Ȼ�����ԭΪ�Ȼ����������������ӷ�ӦΪSn2++2Fe3+=Sn4++2Fe2+��Ȼ��Fe2+�ֱ�Cr2O72-����ΪFe2+�����������ӷ�ӦΪCr2O72-+6 Fe2++14H+=2Cr3++6Fe3++7H2O���ɵ�3Sn~3 Sn2+~6Fe2+~ Cr2O72-������n(Sn)=n(Sn2+)= ![]() n(Cr2O72-)=
n(Cr2O72-)= ![]() =
= ![]() ��m(Sn)=
��m(Sn)= ![]() ������������������������
������������������������![]() =95.2% ��
=95.2% ��