题目内容
【题目】下列说法正确的是
A. 标准状况下,22.4LCCl4中含有的碳原子数为6.02×1023
B. 常温常压下,32gO3中含有的分子数为2×6.02×1023
C. 1mol·L-1Al2(SO4)3中含有的铝离子数为2×6.02×10 23
D. 2molCl2与足量NaOH完全反应,转移电子数为2×6.02×1023
【答案】D
【解析】A、标况下CCl4为液态,不能用气体摩尔体积计算其物质的量,故A错误;B、32g O3的物质的量=![]() mol,则分子数为
mol,则分子数为![]() ×6.02×1023,故B错误;C、没有已知溶液的体积,无法计算铝离子的物质的量,故C错误;D、Cl2与足量NaOH的反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,其中每反应1mol Cl2转移1mol电子,故反应2mol Cl2转移电子数为2×6.02×1023,故D正确,故选D。
×6.02×1023,故B错误;C、没有已知溶液的体积,无法计算铝离子的物质的量,故C错误;D、Cl2与足量NaOH的反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,其中每反应1mol Cl2转移1mol电子,故反应2mol Cl2转移电子数为2×6.02×1023,故D正确,故选D。

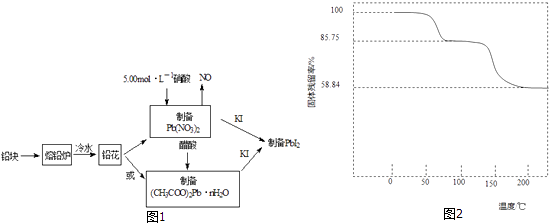
【题目】为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究.已知:碱式碳酸钴受热时可分解生成三种氧化物. 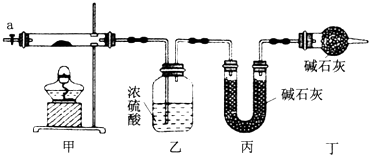
(1)按如图所示装置组装好仪器,并;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是 .
(2)某同学认为上述实验中存在一个缺陷,该缺陷是 .
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为 .
(4)CoCl26H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取COCl26H2O的一种工艺如下: 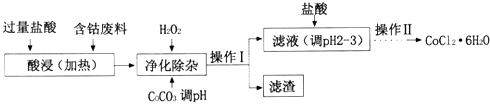
已知;25℃时
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂时,加入H2O2发生反应的离子方程式为;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为;
③加盐酸调整pH为2~3的目的为;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.