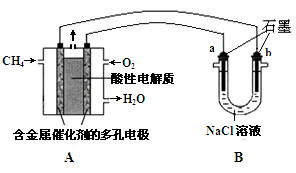
题目内容
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是 。
②若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:
1molN-H键断裂吸收的能量约等于 kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH(填“>”、“<”或“=”)_______0。
(3)已知:
①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)?
 ?2NH3(g) ΔH2=-92.4 kJ·mol-1
?2NH3(g) ΔH2=-92.4 kJ·mol-1③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
氨的催化氧化反应的热化学方程式为
(1)①N2(g)+3H2(g)  2NH3(g) ΔH="–92.2" kJ/mol
2NH3(g) ΔH="–92.2" kJ/mol
②< ③391
(2)①< ②c(NH4+)增大,平衡正向移动 ③32%
(3)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=- 906 kJ·mol-1
解析试题分析:(1)N2(g)+3H2(g)  2NH3(g) ΔH="–92.2" kJ/mol该反应为可逆反应,投入2molN2和6molH2并不能完全反应,故Q<184.4KJ。据化学反应的ΔH等于反应物化学键断裂吸收的能量与产物生成化学键放出的能量之差,可算得1molN-H键断裂吸收的能量约等于 391kJ。(2)随着温度的升高,K变小说明正反应为放热反应,所以ΔH<0。(3)根据盖斯定律可求得氨的催化氧化反应的热化学方程式:2①-2②+3 ③
2NH3(g) ΔH="–92.2" kJ/mol该反应为可逆反应,投入2molN2和6molH2并不能完全反应,故Q<184.4KJ。据化学反应的ΔH等于反应物化学键断裂吸收的能量与产物生成化学键放出的能量之差,可算得1molN-H键断裂吸收的能量约等于 391kJ。(2)随着温度的升高,K变小说明正反应为放热反应,所以ΔH<0。(3)根据盖斯定律可求得氨的催化氧化反应的热化学方程式:2①-2②+3 ③
考点:本题考查热化学与化学平衡理论。

已知反应:3I-(aq)+S2O82-(aq)  I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K= 。
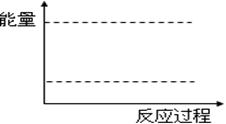
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q 0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是 曲线。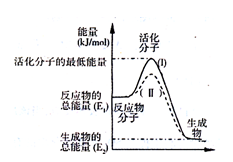
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
从表中数据分析,该实验的目的是 ;
表中显色时间t1= s;最终得出的结论是 。
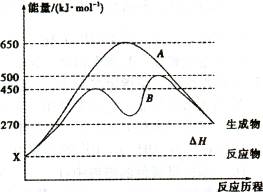


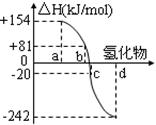
 cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:
 N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。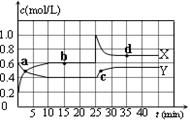
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol