题目内容
(1)已知:①Fe(s)+1/2O2(g)=FeO(s) △H1=-272.0KJ·mol-1
②2Al(s)+3/2(g)=Al2O3(s) △H2=-1675.7KJ·mol-1
Al和FeO发生铝热反应的热化学方程式是__ __。
某同学认为,铝热反应可用于工业炼铁,你的判断是_ (填“能”或“不能”),你的理由 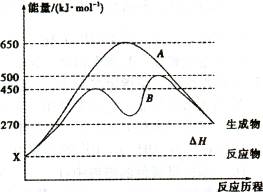
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A.B,如图所示。①据图判断该反应是 (填“吸”或“放” )热反应,当反应达到平衡后,其他条件不变,,升高温度,反应物的转化率将 (填“增大”、 “减小”或“不变”)。
②其中B历程表明此反应采用的条件为
(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(1)2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H="-859.7" kJ?mol-1。不能,该反应需要引发,需要消耗大量能量(2)①吸;减小;②D
解析试题分析::(1)①Fe(s)+1/2O2(g)=FeO(s) △H1=-272.0KJ·mol-1;②2Al(s)+3/2(g)=Al2O3(s) △H2=-1675.7KJ·mol-1;依据盖斯定律②-①×3得到热化学方程式为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H="-859.7" kJ?mol-1。(2)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向逆反应方向移动,反应物的转化率减小,故答案为:吸;减小;②由图可知,反应历程B与A相比,改变反应历程,应是使用催化剂,故答案为:D;
考点:本题考查了本题考查了盖斯定律的应用,热化学方程式的书写方法、化学平衡常数、平衡移动题,注意焓变计算应和化学方程式的系数对应,物质聚集状态的标注。

氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是 。
②若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:
1molN-H键断裂吸收的能量约等于 kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH(填“>”、“<”或“=”)_______0。
(3)已知:
①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)?
 ?2NH3(g) ΔH2=-92.4 kJ·mol-1
?2NH3(g) ΔH2=-92.4 kJ·mol-1③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
氨的催化氧化反应的热化学方程式为
 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
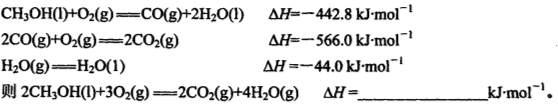
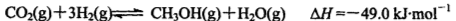
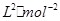 mol;
mol;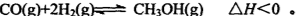

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”) 2SO3(g) △H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
2SO3(g) △H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。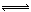 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答: 2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。

 起催化作用,使反应按以下两步完成:
起催化作用,使反应按以下两步完成: