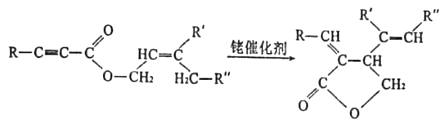
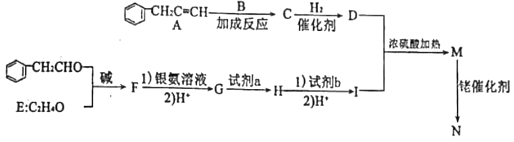
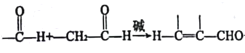
题目内容
【题目】室温下,用0.1mol·L-1的NaOH溶液分别滴定20mL、浓度均为0.1mol·L-1的HCl溶液和HCOOH溶液,溶液中由水电离出的氢离子浓度的对数[1gc(H+)水]随加入NaOH溶液体积的变化如图所示(忽略溶液体积变化),下列说法正确的是( )
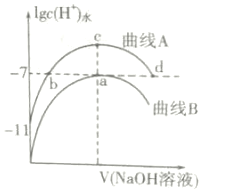
A.该温度下HCOOH的电离常数为Ka=1×10-5
B.a、c两点对应溶液同时升高相同温度,![]() 增大
增大
C.在c点溶液中有:c(HCOO-)+c(HCOOH)=0.1mol·L-1
D.在a、b、c、d四点中对应的溶液呈中性的为a、b、d
【答案】AB
【解析】
A. 未加NaOH时,HCOOH的1gc(H+)水 =11,c(H+)水 =1011 molL1,c(OH-)=c(OH-)水=c(H+)水 =1011 molL1,c(H+) =103 molL1,该温度下HCOOH的电离常数为![]() ,故A正确;
,故A正确;
B. a、c两点对应溶液同时升高相同温度,c(Cl-)基本不变,HCOO-水解程度增大,c(HCOO-)减小,因此![]() 增大,故B正确;
增大,故B正确;
C. 在c点,加入NaOH溶液的体积为20mL,溶液总体积约为40mL,因此溶液中有:c(HCOO-) + c(HCOOH) = 0.05mol·L1,故C错误;
D. 在a溶质为NaCl,呈中性,b溶质为HCOOH和HCOONa的混合溶液,电离程度等于水解程度,溶液呈中性,c溶液为HCOONa,HCOO-水解呈碱性,d点溶质为HCOONa和NaOH,溶液呈碱性,因此呈中性的为a、b,故D错误。
综上所述,答案为AB。

【题目】“花卉保鲜剂”是一种可以延长花期的试剂。如表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(gmol1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.0075 | 170 |
(1)下列“花卉保鲜剂”的成分中,属于非电解质的是______,可做杀菌剂的是____
A. 高锰酸钾B. 硫酸钾C. 蔗糖D. 硝酸银E. 水
(2) 配制1L上述“鲜花保鲜剂”需要高锰酸钾______mol。
(3)在溶液配制过程中,下列操作会使配制结果无影响的是______。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚配制完一定物质的量浓度的氯化钠溶液未洗涤
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为______mol/L。
(5)如果用高铁酸钾(K2FeO4)代替高锰酸钾效果会更好,湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O.碱性条件下,氧化剂与还原剂的物质的量的比为3:2发生反应,写出并配平湿法制备高铁酸钾的离子反应方程式___________________________________________________________