题目内容
(8分)现用氯气与氢氧化钠溶液反应,若耗用的氯气为4.48L (标准状况)。
(1)则选用所贴标签为2.0mol·L-1的氢氧化钠,至少需该氢氧化钠多少毫升?
(2)如选用所贴标签为7%(密度为1.043g·mL-1)的盐酸中和上述反应中所消耗的氢氧化钠,至少需该盐酸多少毫升?
(1)则选用所贴标签为2.0mol·L-1的氢氧化钠,至少需该氢氧化钠多少毫升?
(2)如选用所贴标签为7%(密度为1.043g·mL-1)的盐酸中和上述反应中所消耗的氢氧化钠,至少需该盐酸多少毫升?
(1)200ml (2)200ml
考查物质的量的有关计算。
(1)根据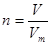 可知
可知
n(Cl2)=4.48L/22.4L·mol-1=0.2 mol
Cl2 + 2NaOH = NaCl+NaClO+H2O
1 2
0.2 mol n(NaOH)
所以n(NaOH)= 0.4 mol
则V(NaOH)= 0.4 mol/2.0 mol·L-1=0.2L=200mL
(2)根据c=n/V可知
c(HCl)=1000mL·L-1×1.043g·mL-1×7%/36.5g·mol-1= 2.0 mol·L-1
HCl + NaOH=NaCl+H2O
1 1
n(HCl) 0.4 mol
所以n(HCl)= 0.4 mol
则V(HCl)= 0.4 mol/2.0 mol·L-1=0.2L=200mL
(1)根据
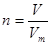 可知
可知n(Cl2)=4.48L/22.4L·mol-1=0.2 mol
Cl2 + 2NaOH = NaCl+NaClO+H2O
1 2
0.2 mol n(NaOH)
所以n(NaOH)= 0.4 mol
则V(NaOH)= 0.4 mol/2.0 mol·L-1=0.2L=200mL
(2)根据c=n/V可知
c(HCl)=1000mL·L-1×1.043g·mL-1×7%/36.5g·mol-1= 2.0 mol·L-1
HCl + NaOH=NaCl+H2O
1 1
n(HCl) 0.4 mol
所以n(HCl)= 0.4 mol
则V(HCl)= 0.4 mol/2.0 mol·L-1=0.2L=200mL

练习册系列答案
相关题目
 L(标准状况)CO中所含氧原子数目相同,则m的数值是( )
L(标准状况)CO中所含氧原子数目相同,则m的数值是( ) 设nA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1,N 14)
设nA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1,N 14)