题目内容
1.已知Cu+2Fe3+═Cu2++2Fe2+,Zn+2Fe3+═Zn2++2Fe2+,现把等物质的量的CuSO4、FeCl3和Zn置于水中,充分反应后,反应器中所得混合物除了SO42-、Cl-外还有( )| A. | Zn2+、Cu、Fe2+ | B. | Zn2+、Cu2+、Fe、Fe2+ | ||
| C. | Zn2+、Cu2+、Fe2+ | D. | Zn2+、Cu2+、Cu、Fe2+ |
分析 由Cu+2Fe3+═Cu2++2Fe2+,Zn+2Fe3+═Zn2++2Fe2+可知,氧化性Fe3+>Cu2+,则等物质的量的CuSO4、FeCl3和Zn置于水中,Zn先与氯化铁反应,再与硫酸铜反应,结合消耗的量分析.
解答 解:由Cu+2Fe3+═Cu2++2Fe2+,Zn+2Fe3+═Zn2++2Fe2+可知,氧化性Fe3+>Cu2+,则等物质的量的CuSO4、FeCl3和Zn置于水中,
设物质的量均为1mol,则发生Zn+2Fe3+═Zn2++2Fe2+可知,剩余0.5molZn继续与硫酸铜反应,则发生Zn+Cu2+=Zn2++Cu,此时溶液中还剩余0.5molCu2+,
则充分反应后,反应器中所得混合物除了SO42-、Cl-外还有Zn2+、Cu2+、Cu、Fe2+,
故选D.
点评 本题考查氧化还原反应,为高频考点,把握习题中的信息及氧化性的强弱、反应的先后顺序为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
10.已知污染性气体氮氧化物能用碱液除去,反应如下:
2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH=2NaNO2+H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液完全吸收的是( )
2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH=2NaNO2+H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液完全吸收的是( )
| A. | 1mol O2和4mol NO2 | B. | 1mol O2和4mol NO | ||
| C. | 1mol NO和5mol NO2 | D. | 4mol NO和1mol NO2 |
9.环己酮是一种重要的有机化工原料,主要用于制造己内酰胺和己二酸.
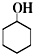 +Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$
+Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$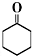 +H2O
+H2O
实验室可用环己醇氧化制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表:
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
实验步骤如下:

①将重铬酸钠溶于适量水,边搅拌边慢慢加入浓H2SO4,将所得溶液冷至室温备用.
②在一圆底烧瓶(乙)中加入适量环己醇,并将①中溶液分三次加入圆底烧瓶,每加一次都应振摇混匀.
控制瓶内温度在55℃~60℃之间,充分反应0.5h.
③向②反应后的圆底烧瓶内加入少量水,并接入图所示装置中,将T形管的活塞K打开,甲瓶中有适量水,加热甲,至有大量水蒸气冲出时,关闭K,同时接通冷凝水.
④将步骤③锥形瓶中收集到的液体经过以下一系列操作可得纯净的环己酮:a、蒸馏,除去乙醚后,收集151℃~155℃馏分;b、水层用乙醚(乙醚沸点34.6℃,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸)萃取,萃取液并入有机层;c、过滤;d、往液体中加入NaCl 固体至饱和,静置,分液; e、加入无水MgSO4固体.根据以上步骤回答下列问题:
(1)步骤①所得溶液分三次加入环己醇的原因是环己醇氧化为环己酮为放热反应,防止温度过高副反应增多.
(2)步骤③利用图示装置进行实验的目的是蒸馏出产品环已酮,实验过程中要经常检查甲中玻管内的水位.若玻管内的水位升高过多,其可能原因是系统有堵塞现象,此时应立即采取的措施是打开止水夹K(让水蒸汽发生器和大气相通).
(3)步骤④中操作的正确顺序是d b e c a,上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需漏斗、分液漏斗,在上述操作d中加入NaCl 固体的作用是增加水层的密度,有利于分层,e中加入无水MgSO4的作用是干燥剂,蒸馏除乙醚的过程中采用的加热方式为水浴加热.
(4)写出该实验中可能发生的一个副反应的化学方程式 .
.
 +Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$
+Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$ +H2O
+H2O实验室可用环己醇氧化制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水和醚 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水,能溶于醚 |
| 水 | 100.0 | 0.9982 |
实验步骤如下:

①将重铬酸钠溶于适量水,边搅拌边慢慢加入浓H2SO4,将所得溶液冷至室温备用.
②在一圆底烧瓶(乙)中加入适量环己醇,并将①中溶液分三次加入圆底烧瓶,每加一次都应振摇混匀.
控制瓶内温度在55℃~60℃之间,充分反应0.5h.
③向②反应后的圆底烧瓶内加入少量水,并接入图所示装置中,将T形管的活塞K打开,甲瓶中有适量水,加热甲,至有大量水蒸气冲出时,关闭K,同时接通冷凝水.
④将步骤③锥形瓶中收集到的液体经过以下一系列操作可得纯净的环己酮:a、蒸馏,除去乙醚后,收集151℃~155℃馏分;b、水层用乙醚(乙醚沸点34.6℃,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸)萃取,萃取液并入有机层;c、过滤;d、往液体中加入NaCl 固体至饱和,静置,分液; e、加入无水MgSO4固体.根据以上步骤回答下列问题:
(1)步骤①所得溶液分三次加入环己醇的原因是环己醇氧化为环己酮为放热反应,防止温度过高副反应增多.
(2)步骤③利用图示装置进行实验的目的是蒸馏出产品环已酮,实验过程中要经常检查甲中玻管内的水位.若玻管内的水位升高过多,其可能原因是系统有堵塞现象,此时应立即采取的措施是打开止水夹K(让水蒸汽发生器和大气相通).
(3)步骤④中操作的正确顺序是d b e c a,上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需漏斗、分液漏斗,在上述操作d中加入NaCl 固体的作用是增加水层的密度,有利于分层,e中加入无水MgSO4的作用是干燥剂,蒸馏除乙醚的过程中采用的加热方式为水浴加热.
(4)写出该实验中可能发生的一个副反应的化学方程式
 .
.
16.想一想:Ba(OH)2(液态)、CuSO4(固态)、纯CH3COOH这些物质为什么归为一类,下列哪些物质还可以和它们归为一类( )
| A. | 碘酒 | B. | HCl(气态) | C. | 水煤气 | D. | 豆浆 |
13.下列氯化物,不能用单质直接反应制得的是( )
| A. | CuCl2 | B. | FeCl2 | C. | NaCl | D. | HCl |
11.当不慎有大量氯气逸出周围空间时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是( )
| A. | Na2CO3 | B. | NaCl | C. | NaOH | D. | KBr |
 ;
; .
.