题目内容
常温下,下列溶液中各微粒浓度关系或pH判定不正确的是
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
| A.将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 |
| B.某物质的溶液中由水电离的c(H+) = 1×10-a mol/L,若a>7,则pH一定为14-a |
| C.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:①>③>② |
| D.CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有: |
B
试题分析:A、反应中硫酸是过量的,所以反应后溶液中c(H+)=
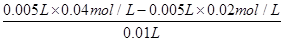 =0.01mol/L,则pH=2,A正确;
=0.01mol/L,则pH=2,A正确;B、某物质的溶液中由水电离的c(H+)=1×10-a mol/L,若a>7,这说明该溶液中水的电离平衡是被破坏的。因此溶液可能显酸性,也可能显碱性,则pH不一定为14-a,也可能是a,B不正确;
C、酸性强弱顺序是醋酸>碳酸>苯酚,酸性越弱,相应的钠盐越容易水解,pH越大。因此pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>②,C正确;
D、根据电荷守恒可知,c(Na+)+c(H+)+c(K+)=c(CH3COO-)+c(OH-)+c(NO3-)。由于c(K+)= c(NO3-),所以c(Na+)+c(H+)=c(CH3COO-)+c(OH-),D正确,答案选B。

练习册系列答案
相关题目
 CH3CH2OH(g) + 3H2O(g)下列叙述错误的是
CH3CH2OH(g) + 3H2O(g)下列叙述错误的是 mC(g)+ nD(g);△H<0,下列说法正确的是
mC(g)+ nD(g);△H<0,下列说法正确的是
 2 SO3的叙述错误的是
2 SO3的叙述错误的是



 N
N