题目内容
【题目】Ⅰ: SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:

① 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________________________。
② 尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________。
(2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。

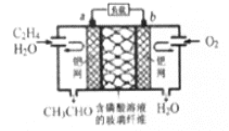
用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的Ba(NO3)2与H2的物质的量之比是__________。
Ⅱ:H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
【ⅰ】H2S的除去: 方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,由图3和图4判断使用硫杆菌的最佳条件为______________。

方法2:在一定条件下,用H2O2氧化H2S
(2)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
【ⅱ】SO2的除去:(双减法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(3)写出过程①的离子方程式:____________________;
【答案】 2SO2+O2+4NH3+2H2O=2(NH4)2SO4 ![]() 1∶8 30 ℃、pH=2.0 H2SO4 2OH+SO2
1∶8 30 ℃、pH=2.0 H2SO4 2OH+SO2![]()
![]() +H2O
+H2O
【解析】Ⅰ:(1)①SO2在O2作用下与NH3、H2O反应形成(NH4)2SO4,此反应中二氧化硫是还原剂,氧气是氧化剂,结合电子守恒和原子守恒可得此反应的化学方程式为2SO2+O2+4NH3+2H2O=2(NH4)2SO4;②吸收NH3的硫酸的物质的量为v1![]() 10-3L
10-3L![]() c1mol/L- v2
c1mol/L- v2![]() 10-3L
10-3L![]() c2mol/L
c2mol/L![]() =(c1v1-
=(c1v1-![]() c2v2)
c2v2)![]() 10-3mol/L,尿素的物质的量为
10-3mol/L,尿素的物质的量为![]() (c1v1-
(c1v1-![]() c2v2)
c2v2)![]() 10-3mol,则尿素溶液中溶质的质量分数是[
10-3mol,则尿素溶液中溶质的质量分数是[![]() (c1v1-
(c1v1-![]() c2v2)
c2v2)![]() 10-3mol×60g/mol
10-3mol×60g/mol![]() ag×100%=
ag×100%=![]() %];(2)由图示可知,第一步反应为H2与Ba(NO3)2作用生成NH3,每摩Ba(NO3)2作用生成NH3共转移16mol电子,根据电子守恒,参加反应的氢气的物质的量为
%];(2)由图示可知,第一步反应为H2与Ba(NO3)2作用生成NH3,每摩Ba(NO3)2作用生成NH3共转移16mol电子,根据电子守恒,参加反应的氢气的物质的量为![]() =8mol,则消耗的Ba(NO3)2与H2的物质的量之比是1: 8;
=8mol,则消耗的Ba(NO3)2与H2的物质的量之比是1: 8;
Ⅱ:(1)根据图3可知,温度30℃左右时,氧化速率最大,根据图4可知,PH=2.0时氧化速率最大,所以使用硫杆菌的最佳条件为30℃、PH=2.0;若反应温度过高,硫杆菌蛋白质变性失去活性造成反应速率下降;(2)根据化合价升降,当n(H2O2)/n(H2S)=4时,4molH2O2转移8mol电子,则1molH2S也转移8mol电子,化合价从-2价升高到+6价,所以氧化产物为H2SO4;(3)过程① 是NaOH与SO2的反应,反应离子方程式为:2OH+SO2![]()
![]() +H2O。
+H2O。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
3 | ⑧ | ⑨ | ⑩ |
(1)自然界物质种类最多的元素在周期表中的位置是____________________。
(2) ⑧⑨⑩的离子半径由大到小的顺序为__________________________(填化学用语)。
(3)写出由⑥⑧⑩元素形成的一种离子化合物的电子式:________________________。
(4)根据对角线元素性质相似规则,写出②的最高价氧化物对应的水化物与盐酸反应的离子方程式:__________________________________________________。
(5)③的氧化物、氢氧化物有两性,写出③的单质与⑧的最高价氧化物对的水化物反应的离子方程式:___________________________________________________________。
(6)已知![]() 分别是由①⑤⑥三种元素中的两种形成的10电子粒子,写出该反应式:________________________________________________。
分别是由①⑤⑥三种元素中的两种形成的10电子粒子,写出该反应式:________________________________________________。