��Ŀ����
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ�~���ڱ��е�λ�ã��ش��������⣺
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | �� | |||||||
2 | �� | �� | �� | �� | �� | �� | ||
3 | �� | �� | �� |
(1)��Ȼ��������������Ԫ�������ڱ��е�λ����____________________��
(2) ��������Ӱ뾶�ɴ�С��˳��Ϊ__________________________���ѧ�����
(3)д���ɢޢ��Ԫ���γɵ�һ�����ӻ�����ĵ���ʽ��________________________��
(4)���ݶԽ���Ԫ���������ƹ���д���ڵ�����������Ӧ��ˮ���������ᷴӦ�����ӷ���ʽ��__________________________________________________��
(5)�۵�������������������ԣ�д���۵ĵ����������������Ե�ˮ���ﷴӦ�����ӷ���ʽ��___________________________________________________________��
(6)��֪![]() �ֱ����ɢ٢ݢ�����Ԫ���е������γɵ�10�������ӣ�д���÷�Ӧʽ��________________________________________________��
�ֱ����ɢ٢ݢ�����Ԫ���е������γɵ�10�������ӣ�д���÷�Ӧʽ��________________________________________________��
���𰸡� �ڶ����ڵ�IVA�� S 2����Cl��>Na+ Na��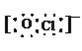 LiOH��H����Li��+H2O Be��2OH��=BeO32-+H2�� NH4++OH��
LiOH��H����Li��+H2O Be��2OH��=BeO32-+H2�� NH4++OH��![]() NH3��+H2O
NH3��+H2O
������������������ɱ���֪������HԪ��������LiԪ��������BeԪ��������CԪ��������NԪ��������OԪ��������FԪ��������NaԪ��������SԪ��������ClԪ����
������(1)��Ȼ��������������Ԫ����CԪ����CԪ�������ڱ��е�λ���ǵڶ����ڵ�IVA����
(2) ���Ӳ���Խ��뾶Խ������Na+�뾶��С�����Ӳ�����ͬʱ������Խ��뾶ԽС������S 2����Cl���������Ӱ뾶�ɴ�С��˳��ΪS 2����Cl��>Na+��
(3)д����O��Na��ClԪ���γɵ����ӻ�����������Ƶĵ���ʽ��Na��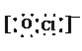 ��
��
(4)���ݶԽ���Ԫ���������ƹ������þ���������ƣ�﮵�����������Ӧ��ˮ������ LiOH�� LiOH�����ᷴӦ�����ӷ���ʽ��LiOH��H����Li��+H2O��
(5)���������������������������Ʒ�Ӧ�����ӷ���ʽ��Be��2OH��=BeO![]() +H2����
+H2����
(6)�ɢ٢ݢ�����Ԫ���е������γɵ�10����������NH![]() ��OH����NH3��H2O���÷�Ӧʽ��NH
��OH����NH3��H2O���÷�Ӧʽ��NH![]() +OH��
+OH��![]() NH3��+H2O��
NH3��+H2O��

 ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д� �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д�����Ŀ�����ǵ����Ϻ����ḻ��Ԫ�أ������仯������о�������������������Ҫ���塣
��1����ͼ��1 mol NO2��1 mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ____________________��

��2����֪��
N2��g��+O2��g��=2 NO��g�� ��H=+180 kJ��mol-1
2NO��g��+2 CO��g��=N2��g��+2 CO2��g����H=��746 kJ��mol-1
��ӦCO��g��+1/2O2��g��=CO2��g���ġ�H=________kJ��mol-1��
��3����һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2 mol��N2��0.6 mol��H2����һ�������·������·�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)��H<0������5minʱ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2mol����ǰ5min��ƽ����Ӧ����v��N2��Ϊ_________��ƽ��ʱH2��ת����Ϊ_________���÷�Ӧ��ƽ�ⳣ��K=__________(����������һλС��)��
2NH3(g)��H<0������5minʱ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2mol����ǰ5min��ƽ����Ӧ����v��N2��Ϊ_________��ƽ��ʱH2��ת����Ϊ_________���÷�Ӧ��ƽ�ⳣ��K=__________(����������һλС��)��
��4���ڹ̶�������ܱ������У�1.0��103kPaʱ����ӦN2(g)+3H2(g)![]() 2NH3(g) ��H <0��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±�����K1_________K2����д��>������=����<����
2NH3(g) ��H <0��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±�����K1_________K2����д��>������=����<����
T/K | 298 | 398 | 498 |
ƽ�ⳣ��K | 51 | K1 | K2 |
��5�������һ�����ܱ���������˵���ϳɰ���Ӧһ���ﵽƽ��״̬����____������ĸ��
a��������N2��H2��NH3��Ũ��֮��Ϊ1�U3�U2
b��NH3��Ũ�ȱ��ֲ���
c��������ѹǿ���ֲ���
d�����������ܶȱ��ֲ���



