题目内容
下列离子在指定溶液中一定能大量共存的是
①加入Al能放出H2的溶液中:SO42-、Na+、K+、Cl-
②中性溶液:Mg2+、Fe3+、SO42-、Cl-(已知Ksp[Fe(OH)3]=2.6×10-39)
③由水电离的c(H+)=10-12mol/L的溶液中:Na+、K+、SO42-、HCO3-
④能使紫色石蕊变红的溶液中:Fe2+、NO3-、I-、Al3+
| A.③④ | B.②④ | C.①② | D.只有① |
D
解析试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。①加入Al能放出H2的溶液可能显酸性,也可能显碱性。SO42-、Na+、K+、Cl-在酸性或碱性条件下都可以大量共存,①正确;根据Ksp[Fe(OH)3]=2.6×10-39可知,铁离子完全沉淀时的OH-浓度是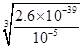 =6.4×10-12,这说明在中性溶液中,铁离子就可以完全沉淀,所以②中铁离子不能大量共存;③由水电离的c(H+)=10-12mol/L的溶液可能显酸性,也可能显碱性。其中HCO3-在酸性或碱性溶液中均不能大量共存,③不正确;④能使紫色石蕊变红的溶液显酸性,在酸性溶液中NO3-具有氧化性,能氧化Fe2+以及I-,不能大量共存,④不正确,答案选D。
=6.4×10-12,这说明在中性溶液中,铁离子就可以完全沉淀,所以②中铁离子不能大量共存;③由水电离的c(H+)=10-12mol/L的溶液可能显酸性,也可能显碱性。其中HCO3-在酸性或碱性溶液中均不能大量共存,③不正确;④能使紫色石蕊变红的溶液显酸性,在酸性溶液中NO3-具有氧化性,能氧化Fe2+以及I-,不能大量共存,④不正确,答案选D。
考点:考查离子共存的正误判断

下列曲线图与对应选项不正确的是( )
| A.向1L浓度均为0.1mol·L–1的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol·L–1稀H2SO4溶液 |
| B.向1L 0.1 mol·L–1 AlCl3和0.3mol/L NH4Cl的混合液中逐滴滴入0.1 mol·L–1NaOH溶液 |
| C.向烧碱溶液中逐滴加入明矾溶液 |
| D.向Ba(OH)2溶液中逐渐通入二氧化碳气体 |
下列反应的化学方程式(或离子方程式)错误的是
A.乙醛与银氨溶液反应 CH3CHO+2[Ag(NH3)2]OH  CH3COONH4+2Ag↓+3NH3+H2O CH3COONH4+2Ag↓+3NH3+H2O |
B.酯的水解反应 CH3CH2OOCCH3+H218O  CH3CH2OH+CH3CO18OH CH3CH2OH+CH3CO18OH |
| C.苯酚与氢氧化钠溶液反应 C6H5OH+OH—→ C6H5O—+H2O |
| D.醋酸溶解水垢(主要成分是碳酸钙)CO32-+CH3COOH →CO2↑+CH3COO-+H2O |
常温下,在下列各组溶液中,加水稀释时c(OH-) / c(H+)值明显增大,且能大量共存的离子组是( )
① K+、Al3+、NO3-、AlO2- ② K+、Fe3+、I-、SO42-
③ Ba2+、I-、NO3-、Na+ ④ Na+、Ca2+、Al3+、 Cl-
| A.①② | B.①③ | C.②④ | D.②③ |
下列离子方程式正确的是
| A.向次氯酸钙溶液通入SO2:Ca2++2ClO?+SO2+H2O=CaSO3↓+2HClO |
| B.向NH4A1(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全 NH4++Al3++2Ba2++2SO42-+4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| C.向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O |
| D.向硝酸银溶液中滴加稀氨水至过量:Ag+ + NH3?H2O=AgOH↓ + NH4+ |
下列离子方程式书写正确的是
| A.澄清石灰水与少量小苏打溶液混合:Ca2+ +2OH- +2HCO3- = CaCO3↓+ CO32- + 2H2O |
| B.氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O = Al(OH)4-↓+ 4NH4+ |
| C.少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O=2C6H5OH+ CO32- |
| D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O |
下列各组离子—定能大量共存的是( )。
| A.在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+ |
| B.在pH=12的溶液中:NH4+、Na+、(SO3)2-、Cl- |
| C.在强碱溶液中:Na+、K+、CO32-、NO3- |
D.在 c(H+)=0.1mol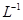 的溶液中:K+、I-、Cl-、NO3- 的溶液中:K+、I-、Cl-、NO3- |
向Na2CO3、NaHCO,混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是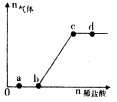
| A.a点对应的溶液中:Na+、OH—、SO2—4、NO—3 |
| B.b点对应的溶液中:Al3+、Fe3+、MnO—4、Cl— |
| C.c点对应的溶液中:Na+.Ca2+.NO—3、Cl— |
| D.d点对应的溶液中:F—、NO—3、Fe2+、Ag+ |
为确定某溶液的离子组成,进行如下实验:
①常温下,测定溶液的pH溶液呈强碱性;②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体;③在②反应后的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;④取上层清液继续滴加 Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验,以下对原溶液中大量存在的离子的推测正确的是
| A.一定含SO32- | B.一定含CO32- | C.C1-一定存在 | D.不能确定HCO3-是否存在 |