题目内容
【题目】下列实验操作与实验目的或结论一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 向0.1mol·L-1 Na2SO4溶液中滴加BaCl2溶液至不再产生沉淀,再滴加0.1mol/L Na2CO3无现象 | 证明Ksp(BaSO4)<Ksp(BaCO3) |
B | 向盛有KI3溶液的两试管中分别滴加淀粉溶液、AgNO3溶液,前者变蓝色,后者有黄色沉淀 | 证明KI3溶液中存在:I3- |
C | 向NaA1O2溶液中持续通入气体,先产生白色沉淀,后沉淀完全溶解 | 该气体可能是CO2 |
D | 在Fe(NO3)2溶液中滴加硫酸酸化的双氧水溶液,溶液变黄色 | 证明氧化性:H2O2>Fe3+ |
A. A B. B C. C D. D
【答案】B
【解析】A.表达式形式相同的难溶物,溶度积常数大的物质能转化为溶度积常数小的物质,硫酸钡、碳酸钡都是白色沉淀,所以转化过程没有明显现象,不能判断二者的大小,故A错误;B.向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液,前者溶液变蓝色,说明溶液中含有碘,后者有黄色沉淀,说明溶液中含有碘离子,原来的溶液是KI3溶液,说明KI3溶液中存在I3-I2+I-平衡,故B正确;C.氢氧化铝只能溶解在强酸中,若Y是CO2气体,观察到出现白色沉淀,沉淀不溶解,即气体不可能是二氧化碳,故C错误;D.酸性溶液中硝酸盐具有强氧化性,则溶液变黄色,可能为亚铁离子被硝酸根离子氧化,故D错误;故选B。

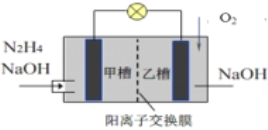
【题目】氨基羧酸盐在工业、农业、生活中都有着十分广泛的应用。氨基甲酸铵(NH2COONH4)可用做肥料、灭火剂、洗涤剂等,甘氨酸亚铁[(NH2CH2COO)2Fe]可用作补铁剂等。
已知:i. 氨基甲酸铵:白色固体,易分解,易水解;甘氨酸亚铁:易溶于水,难溶于乙醇。
ii. 甘氨酸:易溶于水,微溶于乙醇,两性化合物。
iii. 柠檬酸:易溶于水和乙醇,有较强酸性和还原性。
实验室制备方法如下:
I.制备氨基甲酸铵:反应的化学方程式为:2NH3(g)+CO2(g) ![]() NH2COONH4(g) △H<0
NH2COONH4(g) △H<0
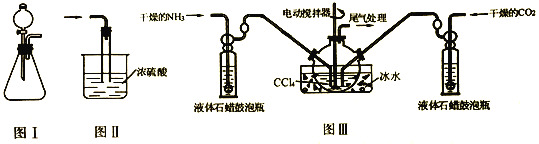
(1)图Ⅰ装置制备NH3,则所选试剂为_________________
(2)图Ⅲ装置制备氨基甲酸铵,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。(注:四氯化碳与液体石蜡均为惰性介质。)
①从反应后的混合物中分离出产品的实验操作是_______________(填操作名称)
②图Ⅱ装置进行尾气处理,则双通玻璃管的作用________________
③液体石蜡鼓泡瓶的作用是________________
④发生器用冰水冷却的原因是________________
II.制备(NH2CH2COO)2Fe:装置如图(夹持和加热仪器已省略), 用CO2气体将装置中空气排净,加入药品后,滴入柠檬酸并加热。反应结束后过滤,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
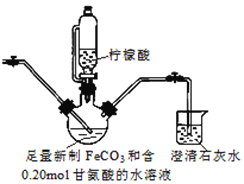
(3)烧杯中澄清石灰水的作用是_______________。
(4)柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
分析pH过低使产率下降的原因是___________;柠檬酸的作用还有_____(填序号)。
a.作反应终点指示剂 b.防止二价铁被氧化 c. 作催化剂 d. 促进FeCO3溶解
(5)乙醇的作用是________________。
(6)若产品的质量为m g,则产率为________________。