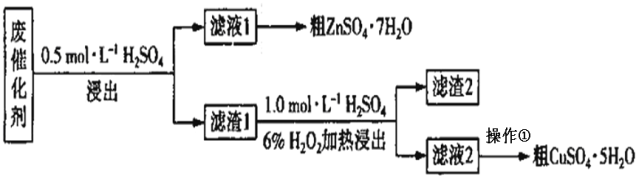
题目内容
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)中,表示该反应速率最快的是:
3C(g)+4D(g)中,表示该反应速率最快的是:
A.V(A)=0.5mol·L-1·s-1B.V(B)=0.3mol·L-1·s-1
C.V(C)=0.8mol·L-1·s-1D.V(D)=1mol·L-1·s-1
【答案】B
【解析】
根据化学反应速率之比等于化学计量数之比,把用不同物质表示的反应速率换算成用同一物质表示的化学反应速率,然后比较大小。
在2A(g)+B(g)![]() 3C(g)+4D(g)反应中都换成B的速率进行比较;
3C(g)+4D(g)反应中都换成B的速率进行比较;
A、V(A):V(B)=2:1,V(B)=0.5mol·L-1·s-1/2=0.25 mol·L-1·s-1;
B、V(B)=0.3mol·L-1·s-1;
C、V(B):V(C)=1:3,V(B)=0.8mol·L-1·s-1/3=0.27mol·L-1·s-1;
D、V(B):V(D)=1:4,V(B)=1mol·L-1·s-1/4=0.25 mol·L-1·s-1;
比较可以知道,B表示的反应速率最块,故B正确;故答案选B。

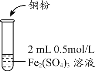
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
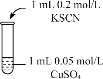
该同学又通过如下实验验证猜想
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
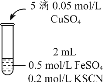
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。
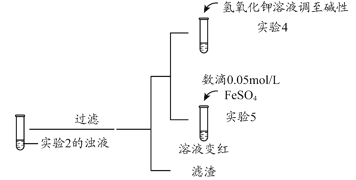
补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
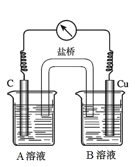
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证