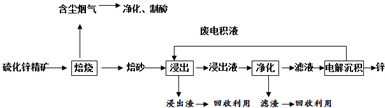
题目内容
5.利用废旧铁皮(有铁锈)制备磁性纳米Fe3O4.制备流程图如图1: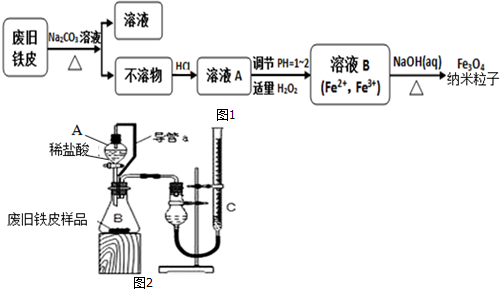
(1)用Na2CO3溶液处理废旧铁皮的作用有A.
A.去除油污B.去除铁锈C.钝化
(2)①写出溶液A到溶液B发生的离子反应方程式2Fe2++2H++H2O2=2Fe3++2H2O.
②由溶液B制得纳米Fe3O4的过程中,须持续通入N2,原因是在N2气流下,防止Fe2+被氧化.
③将制得纳米Fe3O4分散在蒸馏水中,所形成的分散系属于胶体
(3)用如图2装置要粗略测定废铁屑中铁的质量分数,可通过如下装置测出C容器中生成气体的体积.在检查装置气密性,将药品和水装入各仪器中,连接好装置后,还需进行如下操作:
①记录C的液面位置;
②待B中反应结束后并恢复至室温;
③由A向B中滴加足量稀盐酸溶液;
④上下移动C,使干燥管液面和C中液面相平.
Ⅰ上述操作的顺序是③②④①(填序号).
Ⅱ盛放盐酸的仪器名称为分液漏斗.
装置中导管a的作用是保证液体顺利流下,减少收集气体的体积误差.
ⅢB中反应结束标志是容器B中固体完全消失或容器B中不产生气泡.
分析 由制备流程可知,废旧铁皮加碳酸钠溶液除去表面的油污,不溶物为Fe(含铁锈),再与盐酸反应生成氯化铁、氯化亚铁,溶液A中含亚铁离子,加过氧化氢将亚铁离子氧化为铁离子,最后在NaOH溶液中得到纳米Fe3O4;
测定废铁屑中铁的质量分数,C中量筒测定氢气的体积,分液漏斗中为盐酸,导管可使液体顺利流下,不再产生气体时反应结束,反应后冷却,调节液面读数,以此可测定质量分数.
解答 解:(1)用Na2CO3溶液处理废旧铁皮的作用有去油污,油污在碱性条件下水解,故答案为:A;
(2)①溶液A到溶液B发生的离子反应方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
②由溶液B制得纳米Fe3O4的过程中,须持续通入N2,原因是在 N2气流下,防止Fe2+被氧化,故答案为:在 N2气流下,防止Fe2+被氧化;
③将制得纳米Fe3O4分散在蒸馏水中,所形成的分散系属于胶体,故答案为:胶体;
(3)I.上述操作的顺序是③由A向B中滴加足量稀盐酸溶液、②待B中反应结束后并恢复至室温、①记录C的液面位置、④上下移动C,使干燥管液面和C中液面相平,即为③②④①,故答案为:③②④①;
II.盛放盐酸的仪器名称为分液漏斗,装置中导管a的作用是保证液体顺利流下,减少收集气体的体积误差,
故答案为:分液漏斗;保证液体顺利流下,减少收集气体的体积误差;
Ⅲ.B中反应结束标志是容器B中固体完全消失或容器B中不产生气泡,故答案为:容器B中固体完全消失或容器B中不产生气泡.
点评 本题考查物质的制备实验及含量测定,为高频考点,把握物质的性质、发生的反应及测定实验原理、实验技能为解答的关键,侧重分析与实验能力的考查,注意氧化还原的应用,题目难度不大.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | 漂白粉在空气中易变质,所以应密封保存 | |
| B. | 工业上可用铁质容器存放浓硫酸 | |
| C. | 液氯可储存在钢瓶中,便于运输和使用 | |
| D. | 硅酸钠的水溶液俗称“水玻璃”,可保存在带玻璃塞的细口瓶中 |
| A. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| B. | 2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| C. | 200 mL 5 mol•L-1 Na2CO3溶液中,含6.02×1023个CO32- | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
| A. | 氢氧化钠溶液 | B. | 食盐水 | C. | 浓硫酸 | D. | 盐酸 |
| A. | ①②③④⑦ | B. | .①②③④⑤ | C. | .①②③⑥⑧ | D. | .③④⑦⑧⑨ |
| A. | $\frac{m-n}{3}$mL | B. | $\frac{n-m}{3{M}_{1}}$ | C. | $\frac{4m-1}{13}$mL | D. | $\frac{3}{m-n}$mL |
 (1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.
(1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.