题目内容
【题目】我国古代在西汉《淮南子·万毕术》一书中有湿法炼铜的文字记载:“曾青得铁则化铜”铜金属被广泛地应用于电力、电子、交通、轻工、新兴产业等领域。
回答下列问题:
(1)铁原子的外围电子排布图为___________。
(2)向FeCl3溶液加入KSCN溶液形成K3[Fe(SCN)6]血红色溶液。
①写出与SCN-离子互为等电子体的合理分子或离子:_____________。(两个)
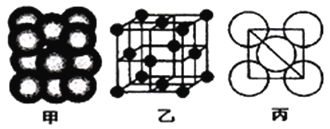
②铁原子的堆积方式如右图(甲)所示,其晶胞特征如右图(乙)所示,原子之间相互位置关系的平面图如右图(丙)所示;已知铁原子半径rpm,铁晶胞空间利用率为:____________。(用字母π表示)
(3)含有Fe2+的水溶液可以用K3[Fe(CN)6]于实验室的定性检验,检验Fe2+离子的离子方程式为:___________。
(4)一水合硫酸四氨合铜[Cu(NH3)4]SO4·H2O为蓝色正交晶体,常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。
①[Cu(NH3)4]SO4·H2O中非金属元素H、N、O的电负性由大到小的顺序为:___________。(用元素符号作答)
②[Cu(NH3)4]SO4·H2O晶体中存在的化学键有___________ (填编号)
a金属键 b离子键 c氢键 d配位键 e极性键 f非极性键
③NH3分子的VSEPR模型为:___________;SO42-中S为___________杂化。
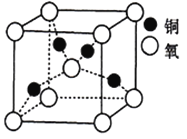
(5)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为acm,则该氧化物的密度为______g/cm3(设阿伏加德罗常数的值为NA)。
【答案】 ![]() CO2、N2O、N3-
CO2、N2O、N3- ![]() 3Fe2++2Fe(CN)63-=Fe3[Fe(CN6)]2↓ O>N>H bde 四面体 sp3
3Fe2++2Fe(CN)63-=Fe3[Fe(CN6)]2↓ O>N>H bde 四面体 sp3 ![]()
【解析】(1)铁为26号元素,原子的外围电子排布式为:3d64s2,外围电子排布图为![]() ;(2)①等电子体是指具有相同价电子数目和原子数目的分子或离子,与SCN-离子互为等电子体的分子和离子分别为CO2、N2O、N3-等;②根据图(乙)所示可知,铁原子晶胞为面心堆积,面对角线长度是原子半径的4倍。假定晶胞边长为a,则a2+a2= (4r)2,a=
;(2)①等电子体是指具有相同价电子数目和原子数目的分子或离子,与SCN-离子互为等电子体的分子和离子分别为CO2、N2O、N3-等;②根据图(乙)所示可知,铁原子晶胞为面心堆积,面对角线长度是原子半径的4倍。假定晶胞边长为a,则a2+a2= (4r)2,a=![]() r,晶胞体积V晶胞=
r,晶胞体积V晶胞=![]() r3。面心立方堆积的晶胞上占有的原子数为4,原子占有的体积为V原子=4×(
r3。面心立方堆积的晶胞上占有的原子数为4,原子占有的体积为V原子=4×(![]() )。晶胞的空间利用率等于
)。晶胞的空间利用率等于![]() =
=![]() =
=![]() ;(3)检验Fe2+离子的离子方程式为:3Fe2++2Fe(CN)63-=Fe3[Fe(CN6)]2↓;(4)①元素非金属性越强,电负性越大,故H、N、O的电负性由大到小的顺序为:O>N>H;②[Cu(NH3)4]SO4·H2O晶体中[Cu(NH3)4]2+与SO42-之间存在离子键,Cu2+与NH3之间形成的化学键为配位键,NH3、SO42-、H2O中均存在极性共价键,故[Cu(NH3)4]SO4·H2O晶体中存在的化学键有离子键、配位键、极性键,答案选bde;③NH3中,价层电子对数=σ键个数+
;(3)检验Fe2+离子的离子方程式为:3Fe2++2Fe(CN)63-=Fe3[Fe(CN6)]2↓;(4)①元素非金属性越强,电负性越大,故H、N、O的电负性由大到小的顺序为:O>N>H;②[Cu(NH3)4]SO4·H2O晶体中[Cu(NH3)4]2+与SO42-之间存在离子键,Cu2+与NH3之间形成的化学键为配位键,NH3、SO42-、H2O中均存在极性共价键,故[Cu(NH3)4]SO4·H2O晶体中存在的化学键有离子键、配位键、极性键,答案选bde;③NH3中,价层电子对数=σ键个数+![]() (a-xb)=3+
(a-xb)=3+![]() (5-3×1)=4,含孤电子对数为1,杂化轨道数4,中心原子以采取sp3杂化,分子的VSEPR模型为正四面体形;SO42-中S的价层电子对数=σ 键个数+
(5-3×1)=4,含孤电子对数为1,杂化轨道数4,中心原子以采取sp3杂化,分子的VSEPR模型为正四面体形;SO42-中S的价层电子对数=σ 键个数+![]() (a-xb)=4+
(a-xb)=4+ ![]() (6+2-4×2)=4,所以采取sp3杂化;(4)分析晶胞示意图可知该晶胞中实际拥有2个氧离子、4个铜离子,可得该铜的氧化物化学式为Cu2O,一个晶胞含有2个“Cu2O”,质量为
(6+2-4×2)=4,所以采取sp3杂化;(4)分析晶胞示意图可知该晶胞中实际拥有2个氧离子、4个铜离子,可得该铜的氧化物化学式为Cu2O,一个晶胞含有2个“Cu2O”,质量为![]() ×144 g,该晶胞的体积为a3 cm3,则该氧化物的密度为
×144 g,该晶胞的体积为a3 cm3,则该氧化物的密度为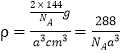 。
。

 名校课堂系列答案
名校课堂系列答案