��Ŀ����
����Ŀ����ͼ1��ʾһЩ�����е�ijЩ�ṹ�����Ƿֱ����Ȼ��ơ��Ȼ�嵐��ɱ������ʯ��ʯī�ṹ�е�ijһ�ֵ�ijһ���֣��ڵ�ɱ�ʾ��ͬ����ͬ�����ӣ���
��1�����д������ʯ������������ĸ����ͬ�������ʯ��ÿ��̼ԭ������̼ԭ����ӽ��Ҿ�����ȣ�
��2�����д���ʯī���� �� ����ÿ����������ռ�е�̼ԭ����ƽ��Ϊ����
��3�����б�ʾ�Ȼ��Ƶ��� �� ÿ����������Χ������ӽ��Ҿ�����ȵ�������������
��4�������Ȼ�蘆��� �� ÿ����������������ӽ��ڣ�
��5�������ɱ����� �� ÿ��������̼��������������̼���ӽ��ڣ�
��6����Mg��C��Ni����Ԫ���γɵ�һ�־��г����Եľ��壬������ͼ2��ʾ��Mgλ��C��Niԭ�ӽ��ܶѻ����γɵĿ�϶���У���һ��Niԭ�Ӿ��������Niԭ�ӵ���ĿΪ �� �þ���Ļ�ѧʽΪ �� ���þ������Է�������ΪM�������ӵ�����ΪNA �� Mg��C��Ni����Ԫ�ص�ԭ�Ӱ뾶�ֱ�Ϊr1pm��r2pm��r3pm����þ�����ܶȱ���ʽΪgcm��3 ��
���𰸡�
��1��D��4
��2��E��2
��3��A��12
��4��C��8
��5��B��12
��6��8��MgNi3C��![]()
���������⣺��1���ڽ��ʯ�����У�ÿ��̼������Χ�ĸ�̼ԭ���γɹ��ۼ��������ĸ�̼ԭ����������������γ��������壬������һ��̼ԭ�ӣ�����ͼDΪ���ʯ��ÿ��̼ԭ�����ĸ�̼ԭ������Ҿ�����ȣ����ʯ�������ɹ��ۼ�����γɵĿռ���״�ṹ�ľ�������ԭ�Ӿ��壻���Դ��ǣ�D��4����2��ʯī�Dz�״�ṹ���ڲ����֮���Է��»�������ã��з��Ӿ�����ص㣬�ڲ���̼��̼�Թ��ۼ�����ã��γ������Σ�����ͼEΪʯī�Ľṹ��Ϊ��Ͼ��壬ÿ��̼ԭ�ӱ����������ι��ã�����ÿ����������ռ��̼ԭ����ƽ��Ϊ6�� ![]() =2�����Դ��ǣ�E��2����3����NaCl�����У�ÿ����������Χ�����������ӣ�ÿ����������ΧҲ�����������ӣ�����ͼAΪNaCl�Ľṹ�����ݾ����Ľṹ��ÿ����������Χ�����������������С���������Խ��ߵ�λ�ã�ÿ����������Χ�а˸������������壬�γ�12���棬������Խ����ϵ������Ӿ���12�������Դ��ǣ�A��12����4��CsCl�������Ӽ��γɵ����Ӿ��壬CsCl�ľ���������Ӻ������ӵ���λ������8����ÿ���������Χ��8�������ӣ�ÿ����������ΧҲ��8������ӣ�����ͼCΪCsCl�Ľṹ�����Դ��ǣ�C��8����5���ɱ��Ƿ��Ӿ��壬CO2����λ��������Ķ���������ϣ��Զ����ϵ�CO2����Ϊ�����������������CO2���ӷֲ�����ö���������12����������ϣ�����ͼBΪ�ɱ����壬���Դ��ǣ�B��12����6������ͼ֪��ͬһ��������ÿ��Niԭ�Ӿ��������Niԭ����4�����ڿռ���ÿ��Niԭ�Ӿ��������Niԭ����8�����þ�����Mgԭ�Ӹ���=1��Cԭ�Ӹ���=8��
=2�����Դ��ǣ�E��2����3����NaCl�����У�ÿ����������Χ�����������ӣ�ÿ����������ΧҲ�����������ӣ�����ͼAΪNaCl�Ľṹ�����ݾ����Ľṹ��ÿ����������Χ�����������������С���������Խ��ߵ�λ�ã�ÿ����������Χ�а˸������������壬�γ�12���棬������Խ����ϵ������Ӿ���12�������Դ��ǣ�A��12����4��CsCl�������Ӽ��γɵ����Ӿ��壬CsCl�ľ���������Ӻ������ӵ���λ������8����ÿ���������Χ��8�������ӣ�ÿ����������ΧҲ��8������ӣ�����ͼCΪCsCl�Ľṹ�����Դ��ǣ�C��8����5���ɱ��Ƿ��Ӿ��壬CO2����λ��������Ķ���������ϣ��Զ����ϵ�CO2����Ϊ�����������������CO2���ӷֲ�����ö���������12����������ϣ�����ͼBΪ�ɱ����壬���Դ��ǣ�B��12����6������ͼ֪��ͬһ��������ÿ��Niԭ�Ӿ��������Niԭ����4�����ڿռ���ÿ��Niԭ�Ӿ��������Niԭ����8�����þ�����Mgԭ�Ӹ���=1��Cԭ�Ӹ���=8�� ![]() =1��Niԭ�Ӹ���=6��
=1��Niԭ�Ӹ���=6�� ![]() =3�������仯ѧʽΪMgNi3C����������=
=3�������仯ѧʽΪMgNi3C����������= ![]() g���ϵ���Խ��߳���=��2r2+2r3��pm=��2r2+2r3����10��10cm���ʾ����ⳤ=
g���ϵ���Խ��߳���=��2r2+2r3��pm=��2r2+2r3����10��10cm���ʾ����ⳤ= ![]() ����2r2+2r3����10��10cm=
����2r2+2r3����10��10cm= ![]() ��r2+r3����10��10cm���������=[
��r2+r3����10��10cm���������=[ ![]() ��r2+r3����10��10cm]3=2
��r2+r3����10��10cm]3=2 ![]() ��r2+r3��3��10��30cm3 �� ���ܶ�=
��r2+r3��3��10��30cm3 �� ���ܶ�= ![]() =
= 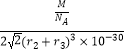 gcm��3=
gcm��3= ![]() gcm��3 �� ���Դ��ǣ�8��MgNi3C��
gcm��3 �� ���Դ��ǣ�8��MgNi3C�� ![]() ��
��

����Ŀ�����ݱ��������ķ���ʽ���й��ɣ��жϿո���������ͬ���칹����Ŀ���ǣ��������칹����������
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C5H12 | C6H12 | C7H16 | C8H16 |
A.3
B.4
C.5
D.6
����Ŀ����һ����Na2O2��NaHCO3��Ϻ����ܱ������м��ȳ�ַ�Ӧ���ų����壬��ȴ���й�������ʣ�࣬����ѡ���ȷ���ǣ�������
Na2O2(mol) | NaHCO3(mol) | ����ɷ� | |
A | 1 | 2 | Na2CO3 |
B | 1.5 | 2 | Na2CO3��NaOH��Na2O2 |
C | 1 | 1 | Na2CO3��NaOH |
D | 2 | 1 | Na2CO3��NaOH��Na2O2 |
A. A B. B C. C D. D