题目内容
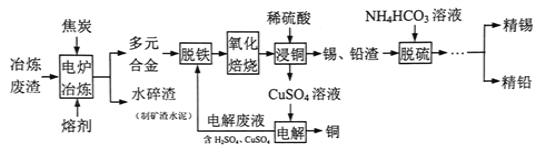
【题目】钨(74W)是熔点最高的金属,是重要的战略物资。自然界中钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:①滤渣I的主要成份是Fe2O3、MnO2。②上述流程中,除最后一步外,其余步骤钨的化合价未变。③常温下钨酸难溶于水。 回答下列问题:
(1)钨酸中钨元素的化合价为_________,写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式___________________________________________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为_______________________________,滤渣Ⅱ的主要成分是_________。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则T1_________T2(填“>”或“<”)。
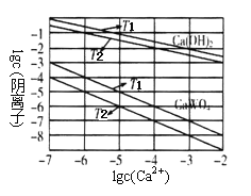
将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_________________,T2时该反应的平衡常数为_________________。
(4)硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2。该阳极反应式为_________________。
【答案】 +6 2MnWO4+O2+4NaOH![]() 2MnO2+2Na2WO4+2H2O HAsO32-+H2O2=HAsO42-+H2O MgSiO3 、MgHAsO4 、MgHPO4 < WO42-+Ca(OH)2(s)=CaWO4(s)+2OH- 1×103 WC+6H2O-10e-=H2WO4↓+CO2↑+10H+
2MnO2+2Na2WO4+2H2O HAsO32-+H2O2=HAsO42-+H2O MgSiO3 、MgHAsO4 、MgHPO4 < WO42-+Ca(OH)2(s)=CaWO4(s)+2OH- 1×103 WC+6H2O-10e-=H2WO4↓+CO2↑+10H+
【解析】(1)根据化合价法则可求出钨元素化合价;MnWO4在熔融条件下发生碱分解,产物有钨酸钠、二氧化锰等。
(2)H2O2为氧化剂,加入后会将HAsO32-氧化为HAsO42-。
(3)二者的溶解度均随温度升高而减小,由图可知二者均是在T2温度下在溶液中的离子浓度更小,可知 T2应大于T1;将钨酸钠溶液加入石灰乳,发生复分解反应,氢氧化钙和钨酸根离子反应生成钨酸钙沉淀;根据该温度下的Ksp 和平衡常数 K进行计算。
(4)阳极析出钨酸并放出CO2,这说明阳极是WC中的碳元素失去电子转化为CO2,W转化为钨酸。
(1)H2WO4中,氢元素为+1价,氧元素为-2价,根据化合价法则可推知,其中的钨元素为+6价;MnWO4在熔融条件下发生碱分解,已知产物应有钨酸钠以及不溶于水的滤渣,推测其为二氧化锰,因此反应的方程式为2MnWO4+O2+4NaOH![]() 2MnO2+2Na2WO4+2H2O;正确答案:+6 ;2MnWO4+O2+4NaOH
2MnO2+2Na2WO4+2H2O;正确答案:+6 ;2MnWO4+O2+4NaOH![]() 2MnO2+2Na2WO4+2H2O。
2MnO2+2Na2WO4+2H2O。
(2)H2O2为氧化剂,加入后会将HAsO32-氧化为HAsO42-,反应方程式为:HAsO32-+H2O2=HAsO42-+H2O;滤渣Ⅱ中主要是不溶于水的镁盐,成分为MgSiO3 、MgHAsO4 、MgHPO4 ;正确答案:HAsO32-+H2O2=HAsO42-+H2O;MgSiO3 、MgHAsO4 、MgHPO4。
(3)①二者的溶解度均随温度升高而减小,由图可知二者均是在T2温度下在溶液中的离子浓度更小,可知 T2应大于T1;正确答案:<。
②T1时观察CaWO4沉淀溶解平衡曲线的起点,此时c(Ca2+)=10-7mol/L 、c(WO42-)=10-4mol/L,可知二者的溶度积常数Ksp=10-11;钨酸钠溶液中加入大量石灰乳得到钨酸钙的离子方程式为WO42-+Ca(OH)2(s)=CaWO4(s)+2OH-,石灰乳和钨酸钙均为沉淀,不写沉淀符号;根据图像可知该温度下KSP[Ca(OH)2]=c(Ca2+)c2(OH-)=1×10-6×(0.1)2=1×10-8,所以该温度下反应的平衡常数K=![]() ;正确答案:WO42-+Ca(OH)2(s)=CaWO4(s)+2OH-; 1×103。
;正确答案:WO42-+Ca(OH)2(s)=CaWO4(s)+2OH-; 1×103。
(4)电解时,用碳化钨做阳极,碳元素被氧化为二氧化碳,W转化为钨酸;在酸性环境下的阳极反应为:WC+6H2O-10e-=H2WO4↓+CO2↑+10H+;正确答案:WC+6H2O-10e-=H2WO4↓+CO2↑+10H+。

 阅读快车系列答案
阅读快车系列答案【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2还原为单质硫的热化学方程式为________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:
CH3OH(g),5分钟后达到平衡测得各组分物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量(mol) | 1.8 | 2.0 | 1.2 |
①反应达到平衡时,CO的转化率为_______,5分钟内用H2表示的速率为________
②该反应的平衡常数K=__________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CO、H2的浓度之比为1:2
E.单位时间内,每生成1mol H2消耗2mol CH3OH
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6 mol CO 和0.4 mol CH3OH,此时v正 __________v逆(填“ >” < ”或“= ”)。