题目内容
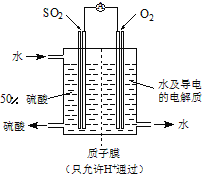
【题目】氯气是一种重要的工业原料,某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。他们利用该反应设计如图所示制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O。他们利用该反应设计如图所示制取氯气并验证其性质的实验。
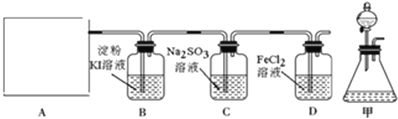
回答下列问题:
(1)该实验中A部分的装置是______(填标号)。
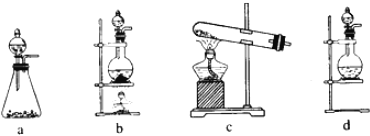
(2)装置B中产生的现象为______。
(3)请设计实验验证装置C中的Na2SO3已被氧化______。
(4)写出D装置中发生反应的离子方程式______。
(5)该实验存在明显的缺陷,请你提出改进的方法______。
(6)若将上述装置改为制取SO2并分别验证SO2的漂白性、氧化性和还原性等性质。B中______溶液褪色,则说明产生的气体为SO2;C中Na2S溶液出现______;D中______溶液褪色,说明SO2有还原性。
【答案】 b 淀粉KI溶液变蓝 取样,加HCl酸化的BaCl2溶液,若有白色沉淀生成,则原试样中Na2SO3已被氧化 2Fe2++Cl2=2Fe3++2Cl- 实验缺少尾气处理装置,应在D后增加一个盛有NaOH溶液的烧杯 品红 淡黄色沉淀 酸性KMnO4溶液或溴水
【解析】
(1)依据反应物状态和反应条件选择发生装置;
(2)氯气与碘化钾反应生成碘单质,碘单质遇到淀粉变蓝;
(3)如果亚硫酸钠被氧化会生成硫酸钠,根据硫酸根离子的检验方法检验即可;
(4)氯气与氯化亚铁反应生成氯化铁;
(5)氯气有毒,应进行尾气处理;
(6)检验二氧化硫用品红溶液;二氧化硫具有氧化性能够氧化硫离子生成单质硫;二氧化硫具有还原型,能够使酸性KMnO4溶液或溴水,据此解答。
(1)依据化学方程式为Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O可知反应物为固体与液体加热条件下反应生成氯气,应选择装置b;
2CaSO4+2Cl2↑+2H2O可知反应物为固体与液体加热条件下反应生成氯气,应选择装置b;
(2)氯气具有强的氧化性,氯气与碘化钾反应生成碘单质,碘单质遇到淀粉变蓝,所以看到现象为:淀粉KI溶液变蓝;
(3)如果亚硫酸钠被氧化,会生成硫酸钠,硫酸钠和氯化钡能发生反应生成白色沉淀硫酸钡,亚硫酸钡也是沉淀,所以要先排除亚硫酸盐的干扰,再用氯化钡检验硫酸根离子,检验方法为:取样,加HCl酸化的BaCl2溶液,若有白色沉淀生成,则原试样中Na2SO3已被氧化;
(4)氯气与氯化亚铁反应生成氯化铁,离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(5)氯气有毒,直接排放能够引起空气污染,应进行尾气处理,可以用氢氧化钠溶液吸收氯气,改进的方法是应在D后增加一个盛有NaOH溶液的烧杯;
(6)二氧化硫具有漂泊性,能够使品红溶液褪色;二氧化硫具有弱的氧化性,能够氧化硫离子生成单质硫,溶液出现淡黄色沉淀;二氧化硫具有还原型,能够使酸性KMnO4溶液或溴水。

【题目】现有部分短周期主族元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是____。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式____(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是____(用元素符号表示),下列表述中能证明这一事实的是____。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)T的一种氧化物能使Z单质的水溶液褪色反应的离子方程式为______。
(5)T在周期表中的位置是第________周期,第_________族。