题目内容
【题目】根据如下框图分析,下列说法正确的是( )
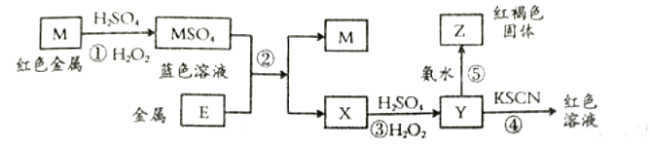
A.![]() 的氧化性比
的氧化性比![]() 的氧化性强
的氧化性强
B.在反应③中若不加稀硫酸可能看到红褐色沉淀
C.反应⑤的离子方程式可表示为![]()
D.在反应①中只能用浓硫酸,既表现酸性,又表现了氧化性
【答案】B
【解析】
根据红色金属和蓝色溶液可知金属M为Cu,根据红褐色固体和加入KSCN后溶液为红色可知金属E为Fe。
A.Fe的金属性大于Cu的金属性,所以Fe2+氧化性小于Cu2+,A错误;
B.由流程可知X为FeSO4,反应③发生的反应为2Fe2++2H++H2O2=2Fe3++2H2O,若不加稀硫酸,可能发生:6Fe2++3H2O2=2Fe(OH)3↓+4Fe3+,故可能看到红褐色沉淀,B正确;
C.Y中含有Fe3+,反应⑤发生的反应的离子方程式为:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+,NH3·H2O 为弱碱,不能拆成离子形式,C错误;
D.Cu转化为CuSO4,可以加浓硫酸,方程式为:Cu+2H2SO4![]() CuSO4+SO2↑+2H2O,也可以与稀硫酸和H2O2一起反应得到CuSO4,方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,D错误;
CuSO4+SO2↑+2H2O,也可以与稀硫酸和H2O2一起反应得到CuSO4,方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,D错误;
答案选B。

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
【题目】如图所示测定溶液导电性实验的装置,甲与乙中盛有浓度相同的不同液体。接通电源后将甲中液体逐滴滴入乙中,发现灯泡由亮→暗灭→亮。下表中甲、乙所盛液体符合要求的是( )

选项 | 甲 | 乙 |
A | 氯化钠溶液 | 硝酸银溶液 |
B | 氨水 | 醋酸 |
C | 稀盐酸 | 碳酸钙悬浊液 |
D | 硫酸铜溶液 | 氢氧化钡溶液 |
A.AB.BC.CD.D