题目内容
下列条件下化学反应速率最大的是( )
| A.20℃0.1mol·L-1的盐酸溶液20 mL与0.5 g块状碳酸钙反应 |
| B.10℃ 0.1mol·L-1的盐酸溶液20 mL与1 g块状碳酸钙反应 |
| C.10℃ 0.2mol·L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 |
| D.20℃ 0.2mol·L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 |
D
解析试题分析:当其他条件不变时,增大反应物的浓度,增加反应物的接触面积,升高温度均能加快化学反应速率,据此判断选D。
考点:考查影响化学反应速率的外界条件。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是①升高温度;②改用100mL 3mol/L盐酸;③改用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
| A.①②④⑤ | B.①③④⑤ | C.①②③④ | D.①②④ |
在容积一定的密闭容器中,反应2A B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是 ( )
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是 ( )
| A.正反应是放热反应,且A是气态 |
| B.正反应是吸热反应,且A不是气态 |
| C.其他条件不变,加入少量A,该平衡向正反应方向移动 |
| D.改变压强对该平衡的移动无影响 |
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )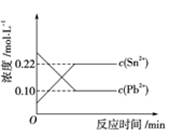
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| D.25 ℃时,该反应的平衡常数K=2.2 |
少量铁片与l00 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.③④⑥⑦⑧ |
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
 2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是
2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是