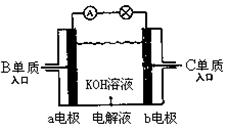
题目内容
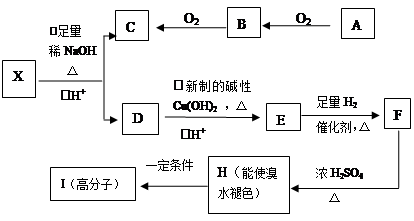
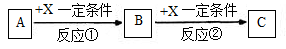
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答: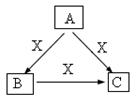
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素的原子结构示意图为 。
②该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为 。
(2)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用化学方程式表明B溶液呈碱性的原因 。
②自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
(1)① ②2Al(s)+Fe2O3(s)
②2Al(s)+Fe2O3(s) Al2O3(s)+2Fe(s); △H=-2QkJ/mol
Al2O3(s)+2Fe(s); △H=-2QkJ/mol
(2)①CO32-+H2O OH-+ HCO3-
OH-+ HCO3-
② 2.65 g
解析试题分析:(1)①若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠,因此可得出A中含金属元素Al的结构示意图。
②该金属元素的单质与某红色氧化物在高温下反应为铝与Fe2O3发生的铝热反应,配平后Al的系数为2,则△H=-2QkJ/mol,则人化学方程式为2Al(s)+Fe2O3(s) Al2O3(s)+2Fe(s); △H=-2QkJ/mol
Al2O3(s)+2Fe(s); △H=-2QkJ/mol
(2)①若A、B、C的焰色反应均呈黄色,水溶液均为碱性,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳。Na2CO3溶液呈碱性的原因是CO32?发生了水解反应,方程式为:CO32-+H2O OH-+ HCO3-。
OH-+ HCO3-。
②溶液中金属阳离子的浓度为0.5 mol?L?1,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为1/2×0.1L×0.5mol/L×106g/mol=2.65g。
考点:本题考查元素化合物推断、结构示意图、方程式的书写以及相关计算。