题目内容
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定NaClO与NaClO3的物质的量之比为1∶3,则Cl2与NaOH溶液反应时被氧化的氯原子与被还原的氯原子的物质的量之比为( )
A. 4∶1 B. 1∶4 C. 3∶11 D. 11∶3
【答案】B
【解析】Cl2被氧化生成ClO-与ClO3-,Cl2被还原有生成NaCl,NaClO与NaClO3的的物质的量之比为1∶3,假设ClO-与ClO3-的物质的量分别为1mol、3mol,根据电子转移守恒,Cl-的物质的量=![]() =16mol,根据Cl原子守恒,被氧化的氯原子与被还原的氯原子的个数比=(3mol+1mol):16mol=1:4,答案选B。
=16mol,根据Cl原子守恒,被氧化的氯原子与被还原的氯原子的个数比=(3mol+1mol):16mol=1:4,答案选B。

 津桥教育计算小状元系列答案
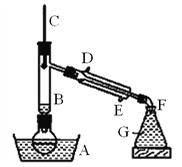
津桥教育计算小状元系列答案【题目】用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答:
(1)将称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是________。
(2)用_______式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞。
(3)用0.20molL-1的标准盐酸滴定待测液,判断滴定终点的现象是:_______。
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是_______(填答案字母序号)。
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Cl-)+c(Na+)>c(OH-)+c(H+)
(5)根据下列数据计算,c(NaOH)_____mol/L,烧碱的纯度为_____%(保留整数)。
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.60 | 20.50 |
第二次 | 10.00 | 3.00 | 23.10 |
(6)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是_________(填答案字母序号)。
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
F.滴定前尖嘴有气泡,滴定后消失