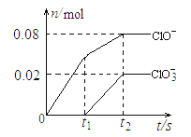
题目内容
【题目】某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
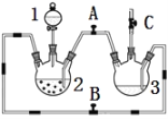
(1)稀硫酸应放在中___(填写仪器名称).
(2)本实验通过控制A、B、C三个开关将仪器中的空气排尽后,再关闭开关___、打开开关___,就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由___。
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是___。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为了洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
Ⅰ.滴定过程中发生反应的离子方程式为___。
Ⅱ.上表中第一次实验中记录数据明显大于后两次,其原因可能是___(填字母代号)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴无气泡,滴定结束有气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
Ⅲ.通过实验数据计算的该产品纯度为___(用字母a、c表示)。
【答案】分液漏斗 B(或BC) A 防止生成的氢氧化亚铁被氧化 将铁粉换成铁钉或铁块 D MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O C ![]() ×100%
×100%
【解析】
铁与稀硫酸反应生成硫酸亚铁和氢气,利用生成的氢气将硫酸亚铁溶液压入氢氧化钠溶液中,以制备氢氧化亚铁。因氢氧化亚铁易被氧化,故应利用氢气排出装置内的空气。
(1)利用铁屑、稀硫酸、氢氧化钠溶液制备氢氧化亚铁,应将铁与稀硫酸反应生成硫酸亚铁,再利用生成的氢气将硫酸亚铁溶液压入氢氧化钠溶液中。故稀硫酸放入仪器1(分液漏斗)、铁屑放入仪器2、氢氧化钠溶液放入仪器3。
(2)为防止装置内的空气氧化氢氧化铁,可利用生成的氢气排出装置内的空气,故关闭A、打开B和C,打开分液漏斗活塞加入稀硫酸。等氢气排出空气后,打开A、关闭B,则仪器2中生成的硫酸亚铁溶液被压入仪器3中,在仪器3中生成白色的氢氧化亚铁沉淀。
(3)实验时仪器2中铁粉易通过导管进入仪器3中,使氢氧化亚铁不纯。可将铁粉换成铁钉或铁块。
(4)①因摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O]易溶于水、不溶于乙醇。为减少溶解损耗,洗涤(NH4)2SO4·FeSO4·6H2O粗产品时应用酒精、而不能用水,故使用90%的乙醇溶液洗涤(选D)。
②I.滴定时,酸性KMnO4溶液氧化样品溶液中的Fe2+,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O。
Ⅱ.A.实验结束时俯视刻度线读数,会使消耗高锰酸钾的溶液体积偏小;
B.滴定前滴定管尖嘴无气泡,滴定结束有气泡,也使消耗高锰酸钾的溶液体积偏小;
C.第一次滴定用的锥形瓶用待装液润洗过,使消耗高锰酸钾的溶液体积偏大;
D.酸性高锰酸钾标准液保存时间过长,有部分变质使浓度降低,则三次测定消耗高锰酸钾的溶液体积均偏大(系统误差)。
第一次实验时消耗高锰酸钾溶液体积明显大于后两次,应为偶然因素引起的误差,只有C项可能。
Ⅲ.第一次消耗高锰酸钾溶液的体积存在偶然误差,应舍弃。取第二次、第三次的平均值(25.00mL)作为标准高锰酸钾溶液的体积。据MnO4-~5Fe2+~5[(NH4)2SO4·FeSO4·6H2O],产品的纯度为(c mol·L-1×25.00×10-3L×5×392g·mol-1×![]() /a g)×100%=
/a g)×100%=![]() ×100%。
×100%。

 阅读快车系列答案
阅读快车系列答案【题目】(双选)在1 L密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
| c(NH3) (mol/L) | c(O2) (mol/L) | c(NO) (mol/L) |
起始 | 0.8 | 1.6 | 0 |
第2min | 0.6 | a | 0.2 |
第4min | 0.3 | 0.975 | 0.5 |
第6min | 0.3 | 0.975 | 0.5 |
第8min | 0.7 | 1.475 | 0.1 |
第10min | 0.7 | 1.475 | 0.1 |
下列说法错误的是
A.反应在第2 min到第4min时,O2的平均反应速率为0.1875 mol/(L·min)
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min时、第8 min时分别达到化学平衡,且平衡常数不相同
D.在开始反应的前2 min内,该反应的△H=-0.05Q kJ·mol-1