题目内容
(2011?厦门一模)下列说法正确的是( )
分析:A、酸雨的主要成分是亚硫酸、硫酸等;
B、具有氧化性的物质往往具有消毒作用,但浓度过大可能会对人体有害;
C、原电池中,活泼金属做负极,易被腐蚀,正极易被保护;
D、海水中碘元素以化合态存在,不是游离态.
B、具有氧化性的物质往往具有消毒作用,但浓度过大可能会对人体有害;
C、原电池中,活泼金属做负极,易被腐蚀,正极易被保护;
D、海水中碘元素以化合态存在,不是游离态.
解答:解:A、酸雨的主要成分中的亚硫酸易被空气氧化为硫酸,导致酸雨酸性增强,故A正确;
B、具有氧化性的物质臭氧具有消毒作用,但浓度过大可能会对人体有害,不是浓度越大越好,故B错误;
C、原电池中,活泼金属做负极,易被腐蚀,正极被保护,一般在入海口的钢闸门上装一定数量的比铁活泼的金属如锌块可防止闸门被腐蚀,故C错误;
D、海水中碘元素以化合态存在,不是游离态,需经过化学变化才可以从海水中提取碘,故D错误.
故选A.
B、具有氧化性的物质臭氧具有消毒作用,但浓度过大可能会对人体有害,不是浓度越大越好,故B错误;
C、原电池中,活泼金属做负极,易被腐蚀,正极被保护,一般在入海口的钢闸门上装一定数量的比铁活泼的金属如锌块可防止闸门被腐蚀,故C错误;
D、海水中碘元素以化合态存在,不是游离态,需经过化学变化才可以从海水中提取碘,故D错误.
故选A.
点评:本题是一道化学知识的综合应用题,考查角度广,要求学生熟记教材知识,学以致用.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
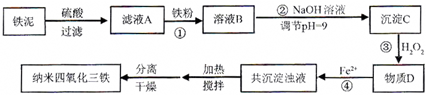
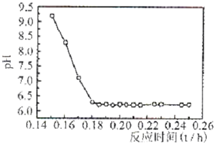
 (2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答
(2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答