题目内容
(2011?厦门一模)设阿伏加德罗常数为NA,下列说法正确的是( )
分析:A、根据n=
计算4He的物质的量,4He中子数为2,再根据N=nNA计算中子数目.
B、根据pH值计算氢离子浓度,再根据Kw计算氢氧根的浓度,利用n=cV计算氢氧根的物质的量,根据N=nNA计算氢氧根数目.
C、铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,氢元素化合价由+1价降低为0价,根据氢气计算电子转移.
D、根据n=
计算乙烷的物质的量,每个乙烷分子含有7个共价键,再根据N=nNA计算共价键数目.
| m |
| M |
B、根据pH值计算氢离子浓度,再根据Kw计算氢氧根的浓度,利用n=cV计算氢氧根的物质的量,根据N=nNA计算氢氧根数目.
C、铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,氢元素化合价由+1价降低为0价,根据氢气计算电子转移.
D、根据n=
| V |
| Vm |
解答:解:A、4He中子数为2,6g4He含中子数为
×2×NAmol-1=3NA,故A错误;
B、pH=13的Ba(OH)2溶液,c(OH-)=0.1mol/L,所以1.0LpH=13的Ba(OH)2溶液含OH-数目为1.0L×0.1mol/L×NAmol-1=0.1NA,故B错误;
C、铝与氢氧化钠溶液反应生成1mol氢气时,转移的电子数为1mol×2×NAmol-1=2NA,故C错误;
D、标准状况下,22.4L乙烷含共价键数目为
×7×NAmol-1=7NA,故D正确.
故选:D.
| 6g |
| 4g/mol |
B、pH=13的Ba(OH)2溶液,c(OH-)=0.1mol/L,所以1.0LpH=13的Ba(OH)2溶液含OH-数目为1.0L×0.1mol/L×NAmol-1=0.1NA,故B错误;
C、铝与氢氧化钠溶液反应生成1mol氢气时,转移的电子数为1mol×2×NAmol-1=2NA,故C错误;
D、标准状况下,22.4L乙烷含共价键数目为
| 22.4L |
| 22.4L/mol |
故选:D.
点评:考查常用化学计量数的有关计算,难度不大,注意公式的运用.

练习册系列答案
相关题目
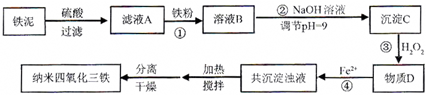
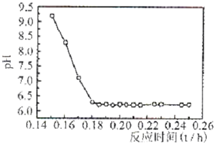
 (2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答
(2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答