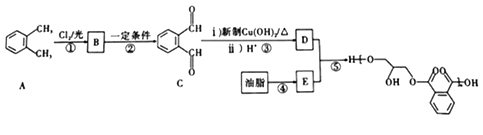
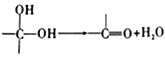
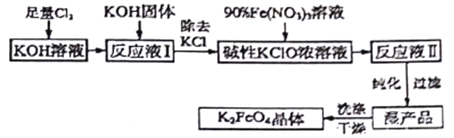
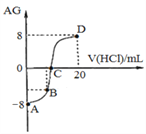
��Ŀ����
����Ŀ����֪XԪ�ص�ԭ�ӵ�K��L��ĵ�����֮�ͱ�L��M��ĵ�����֮�Ͷ�1�����ӣ�YԪ�ص�ԭ���������������ڲ��������3����ZԪ�غ�����3�����Ӳ㣬�������3�����ӣ�WԪ������ϼ�����ͻ��ϼ۾���ֵ��3������������������е���������Ϊ40%��
��1��Y��W����̬�⻯����ȶ��ԣ��û�ѧʽ��ʾ����
��2���õ���ʽ��ʾX��W�γɻ�����Ĺ���
��3��X�����ڿ����м������ɵĻ�����ĵ���ʽ
��4��X��Z������������Ӧˮ���ﷴӦ�����ӷ���ʽ
��5��Y��Z�γɻ�����Ļ�ѧʽ�� �� ʵ���õ��˻����ﴦ�ڹ�̬��Һ̬ʱ�����磬����ˮ�ܵ��磮�ɴ��жϸû�����������������ӻۣ�
��6��W�ĵͼ���������Y���ʵ�ˮ��Һ��Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��HCl��H2S
��2��![]()
��3��![]()
��4��Al��OH��3+OH���TAlO2��+2H2O
��5��AlCl3������
��6��SO2+Cl2+2H2O�TH2SO4+2HCl
���������⣺XԪ��ԭ�ӵ�K��L��ĵ�����֮�ͱ�L��M��ĵ�����֮�Ͷ�1�����ӣ�K���е�������2����M���������1������X��NaԪ�أ�YԪ�ص�ԭ���������������ڲ��������3��������������������8���������ڲ��������10������������Ϊ7����Y��ClԪ�أ�ZԪ�غ�����3�����Ӳ㣬�������3�����ӣ���Z��AlԪ�أ�WԪ������ϼ�����ͻ��ϼ۾���ֵ��3����Wλ�ڵ�VIA�壬���������ΪWO3 �� �����������W����������Ϊ40%���� ![]() =40%�����Mr��W��=32����W��SԪ�أ�
=40%�����Mr��W��=32����W��SԪ�أ�
��1.��Y��W����̬�⻯��ֱ���HCl��H2S��ͬһ�����У�Ԫ�ص��⻯���ȶ�������ԭ���������������������Y��W���ȶ���ΪHCl��H2S���ʴ�Ϊ��HCl��H2S��
��2.��ʾX��W�γɻ�����ΪNa2S���õ���ʽ��ʾ�γɹ���Ϊ�� ![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ����3.��X�����ڿ����м������ɵĻ�������Na2O2 �� ����ʽΪ��
����3.��X�����ڿ����м������ɵĻ�������Na2O2 �� ����ʽΪ�� ![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ��
��
��4.��X������������ˮ������NaOH��Z������������ˮ������Al��OH��3 �� ��������������������Һ��Ӧ����ƫ�����ƺ�ˮ�����ӷ���ʽΪ��Al��OH��3+OH���TAlO2��+2H2O���ʴ�Ϊ��Al��OH��3+OH���TAlO2��+2H2O��
��5.����Y��Z�γɻ�������AlCl3 �� ��̬��Һ̬�Ȼ��������磬����ˮ�ܵ��磬˵���Ȼ���������״̬��Ϊ���ӣ����ܵ���������ƶ����������ӣ������Ȼ����ǹ��ۻ����ֻ�����ۼ����ʴ�Ϊ��AlCl3�����ۣ�
��6.��W�ĵͼ���������SO2 �� Y���ʵ�ˮ��Һ����ˮ����������������ˮ����������ԭ��Ӧ����������Ȼ��⣬��Ӧ����ʽΪ��SO2+Cl2+2H2O�TH2SO4+2HCl���ʴ�Ϊ��SO2+Cl2+2H2O�TH2SO4+2HCl��
XԪ��ԭ�ӵ�K��L��ĵ�����֮�ͱ�L��M��ĵ�����֮�Ͷ�1�����ӣ�K���е�������2����M���������1������X��NaԪ�أ�YԪ�ص�ԭ���������������ڲ��������3��������������������8���������ڲ��������10������������Ϊ7����Y��ClԪ�أ�ZԪ�غ�����3�����Ӳ㣬�������3�����ӣ���Z��AlԪ�أ�WԪ������ϼ�����ͻ��ϼ۾���ֵ��3����Wλ�ڵ�VIA�壬���������ΪWO3 �� �����������W����������Ϊ40%���� ![]() =40%�����Mr��W��=32����W��SԪ�أ�
=40%�����Mr��W��=32����W��SԪ�أ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�