题目内容
元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满。若发现119号元素,请在“元素大厦”中安排好它的“房间”
| A.第七周期0族 | B.第六周期第ⅡA族 |
| C.第八周期第ⅠA族 | D.第七周期第ⅦA族 |
C
解析试题分析:稀有气体最后一种元素原子序数为86,在第六周期,排满第七周期为32种元素,第七周期的稀有气体原子序数为118,故119号在下一周期的第ⅠA族,C正确;故选C。
考点:同主族原子序数的差值的应用。

练习册系列答案
相关题目
如果发现了原子序数为116的元素,下列对它的叙述中正确的是 ( )
①位于第7周期 ②非金属元素 ③最外电子层有6个电子 ④没有放射性 ⑤属于氧族元素 ⑥属于锕系元素
| A.①③⑤ | B.②④⑥ | C.①③⑥ | D.③④⑤ |
最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,并用质谱仪探测到了它存在的证据。下列说法正确的是
| A.O4是氧元素的一种同位素 |
| B.O4可能含有极性键 |
| C.同温同压下,等体积的O4气体和O2含有相同的分子数 |
| D.O4转化O2为物理变化 |
短周期元素甲,乙,丙,丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数和电子层数相等,则 ( )
| A.原子半径:丙>丁>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲,乙,丙的氧化物均为共价化和物 |
| D.乙,丙,丁的最高价氧化物对应的水化物能相互反应 |
W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z- ,Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )
| A.原子最外层电子数:X>Y>Z | B.单质沸点:X>Y>Z |
| C.离子半径:X2->Y+>Z- | D.原子序数:X>Y>Z |
锗(Ge)是第四周期第IVA族元素,处于元素周期表中金属区与非金属区的交界线处,下列叙述正确的是( )
| A.锗是一种金属性很强的元素 | B.锗的单质具有半导体的性能 |
| C.锗化氢(GeH4)稳定性很强 | D.锗酸(H4GeO4)是难溶于水的强酸 |
关于下列图示的说法中正确的是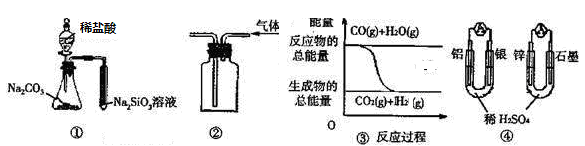
| A.用图 ① 所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
B.用图 ② 所示实验装置排空气法收集CO2气体 | C.图 ③ 表示反应 CO(g)+H2O(g) CO2(g)+H2(g)是放热反应 |
| D.图 ④ 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
下图是元素周期表短周期的一部分,Y、W的质子数之和为25。下列说法正确的是
| | X | | Y |
| Z | | W | |
A.非金属性:W>Z
B.原子半径:X<Y
C.Z的最高价氧化物可溶于Y的氢化物的水溶液
D.Y的最高价氧化的水化物酸性强于W最高价氧化的水化物