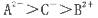题目内容
锗(Ge)是第四周期第IVA族元素,处于元素周期表中金属区与非金属区的交界线处,下列叙述正确的是( )
| A.锗是一种金属性很强的元素 | B.锗的单质具有半导体的性能 |
| C.锗化氢(GeH4)稳定性很强 | D.锗酸(H4GeO4)是难溶于水的强酸 |
B
解析试题分析:A、锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,反应中既不易得电子,也不易失去电子,故A错误;B、锗处于金属区与非金属区的交界线上,既有金属性又有非金属性,常用于做半导体材料,故B正确;C、锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,锗化氢(GeH4)稳定性很差,故C错误;锗和硅处于同一主族,主族元素的非金属性从上到下逐渐减弱,则硅的非金属性大于锗,非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性比硅酸弱,为弱酸.碳酸溶液水,硅酸不溶于水,推知锗酸(H4GeO4)应难溶于水,故D错误;故选B。
考点:考查了位构性的关系。

练习册系列答案
相关题目
元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满。若发现119号元素,请在“元素大厦”中安排好它的“房间”
| A.第七周期0族 | B.第六周期第ⅡA族 |
| C.第八周期第ⅠA族 | D.第七周期第ⅦA族 |
对发现元素周期律贡献最大的化学家是 ( )
| A.牛顿 | B.道尔顿 | C.阿伏加德罗 | D.门捷列夫 |
下列各组顺序的排列不正确的是
| A.原子半径:Na>Mg>Al | B.热稳定性:HCl> H2S>PH3 |
| C.还原性:I–<Br–<Cl– | D.熔点:金刚石>食盐>干冰 |
下列各组中两种微粒所含电子数不相等的是
| A.H3O+和OH- | B.CO和N2 | C.HNO2和NO2- | D.CH3+和NH4+ |
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。 下列有关说法中,正确的是
| A.N5+ 离子中含有36个电子 | B.H2与H3属于同素异形体 |
| C.C60的摩尔质量为720 | D.O2与O4属于同位素 |