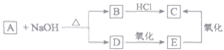
题目内容
18.A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B的最高价含氧酸可与其气态氢化物反应生成盐,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.用元素符号或化学式回答下列问题.(1)X在周期表中的位置是第二周期第ⅥA族;五种元素的原子半径从大到小的顺序是Na>S>N>O>H;化合物Y2X2的电子式为
 .
.(2)X、Z的简单氢化物中沸点较高的是H2O;原因是水分子间存在氢键.
(3)A与X和A与Z均能形成18个电子的化合物,这两种化合物发生反应可生成Z,其反应的化学方程式为:H2O2+H2S=S↓+2H2O;
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为:H2-2e-+2OH-=2H2O.
(5)写出化合物Y2X2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
分析 A、B、X、Y和Z是原子序数依次递增的短周期元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则Y2X2为Na2O2,X为O元素,Y为Na;X与Z同主族,则Z为S元素;A与Y同主族,A与X可形成10个电子化合物,则A为H元素;B的最高价含氧酸可与其气态氢化物反应生成盐,则B为N元素,据此解答.
解答 解:A、B、X、Y和Z是原子序数依次递增的短周期元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则Y2X2为Na2O2,X为O元素,Y为Na;X与Z同主族,则Z为S元素;A与Y同主族,A与X可形成10个电子化合物,则A为H元素;B的最高价含氧酸可与其气态氢化物反应生成盐,则B为N元素.
(1)X为O元素,在周期表中的位置是:第二周期第ⅥA族;五种元素的原子半径从大到小的顺序是:Na>S>N>O>H,化合物Na2O2的电子式为 ,
,
故答案为:第二周期第ⅥA族;Na>S>N>O>H; ;
;
(2)水分子间存在氢键,沸点高于硫化氢,
故答案为:H2O;水分子间存在氢键;
(3)H与O和H与S均能形成18个电子的化合物,这两种化合物发生反应可生成S,应是H2O2、H2S反应生成硫与水,反应的化学方程式为:H2O2+H2S=S↓+2H2O,
故答案为:H2O2+H2S=S↓+2H2O;
(4)氢气、氧气制成新型的化学电源(KOH溶液作电解质溶液),负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2-2e-+2OH-=2H2O,
故答案为:H2-2e-+2OH-=2H2O;
(5)化合物Na2O2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑.
点评 本题考查元素位置结构性质的关系、无机物推断、原电池等,推断元素是解题关键,题目难度中等,学习中注重相关基础知识的积累.

| A. | 石油分馏出的各馏分均是纯净物 | |
| B. | 纤维素、淀粉、蛋白质和天然油脂都属于天然高分子化合物 | |
| C. | 煤可与水蒸气反应制成水煤气,水煤气的主要成分为CO和H2 | |
| D. | 1mol蔗糖在酸性条件下水解得到2mol葡萄糖 |
| A. | 升高温度能加快反应速率 | |
| B. | 增大SO2的浓度能加快反应速率 | |
| C. | 加入道量的O2可使SO2的转化率达到100% | |
| D. | 使用恰当的催化剂能加快反应速率 |
| A. | 往某固体中滴加稀盐酸有气泡产生--该固体一定是碳酸盐 | |
| B. | 往某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀--该溶液一定含有硫酸根离子 | |
| C. | 生石灰块投入水中,水会沸腾--生石灰变成熟石灰的过程是放热反应 | |
| D. | 往品红溶液中通入某种气体,使品红褪色--该气体一定是二氧化硫 |
| A. | 苯能使酸性KMnO4溶液褪色 | |
| B. | 苯与稀硝酸、稀硫酸混合加热,生成硝基苯 | |
| C. | 苯与溴水混合振荡,静置,下层液体几乎为无色 | |
| D. | 1mol苯与2mol氢气发生加成反应生成1mol环己烷 |
| A. | 118 | B. | 175 | C. | 47 | D. | 293 |
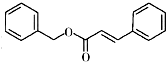 )俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线:
)俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线: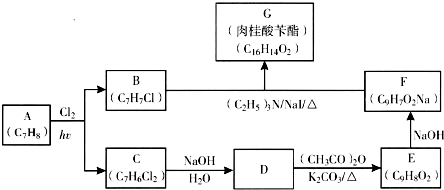
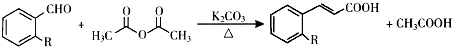
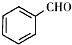 ;
;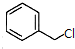 +
+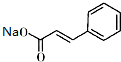 $\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$
$\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$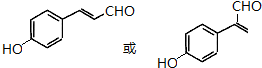 (写结构简式,若有多种可能,只写一种).
(写结构简式,若有多种可能,只写一种).