题目内容
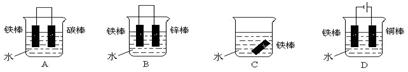
如图所示3套实验装置,分别回答下列问题。
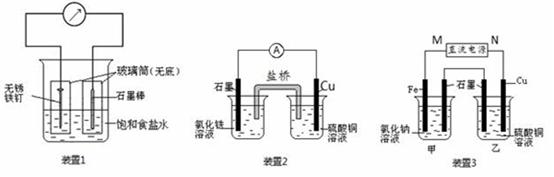
(1)装置1为铁的吸氧腐蚀实验。一段时间后,溶液略显浅绿色,表明铁被 (填“氧化”或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
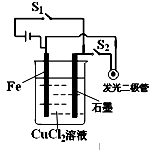
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程为 。
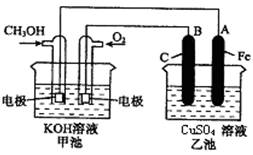
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为 极;甲烧杯中铁电极的电极反应为 。
②乙烧杯中电解反应的离子方程式为 。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中产生的气体标准状况下体积为 mL。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,溶液略显浅绿色,表明铁被 (填“氧化”或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程为 。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为 极;甲烧杯中铁电极的电极反应为 。
②乙烧杯中电解反应的离子方程式为 。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中产生的气体标准状况下体积为 mL。
(1)氧化(2分) O2+ 4e- +2H2O=4OH-(2分)
(2)正(2分) 2Fe3++Cu =2Fe2++Cu2+(2分)
(3)①正(2分) Fe-2e-=Fe2+(2分)
②2Cu2++2H2O 2Cu+O2↑+4H+(3分)
2Cu+O2↑+4H+(3分)
③224(2分)
(2)正(2分) 2Fe3++Cu =2Fe2++Cu2+(2分)
(3)①正(2分) Fe-2e-=Fe2+(2分)
②2Cu2++2H2O
 2Cu+O2↑+4H+(3分)
2Cu+O2↑+4H+(3分)③224(2分)
试题分析:(1)装置1为铁的电化学腐蚀,铁钉附近的溶液有蓝色沉淀,表明铁被氧化,铁为负极,碳为正极。观察到碳棒附近的溶液变红,说明在碳极上氧气得电子生成OH-离子,反应的电极反应式为O2+4e-+2H2O=4OH-。
(2)装置2为原电池,负极为Cu,铜失去电子,生成铜离子而溶解。石墨是正极,溶液中的铁离子得到电子生成亚铁离子,所以总的离子方程式是2Fe3++Cu=2Fe2++Cu2+。
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,即石墨是阴极,所以铁是阳极,M是电源的正极,则铁电极的方程式是Fe-2e-=Fe2+。
②乙烧杯电解硫酸铜溶液,石墨为阳极,铜是阴极,所以电解的总方程式是2CuSO4+2H2O 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为0.64g÷64g/mol =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol
根据甲烧杯产生气体的电极反应可知
2H++2e-=H2↑
2mol 22.4L
0.02mol V
所以V=0.224L。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,侧重考查学生分析问题、解决问题的能力。做题时要注意电极的判断和电极反应的书写,注意串联电路中各电极转移的电子数目相等,利用反应的方程式计算即可。
(2)装置2为原电池,负极为Cu,铜失去电子,生成铜离子而溶解。石墨是正极,溶液中的铁离子得到电子生成亚铁离子,所以总的离子方程式是2Fe3++Cu=2Fe2++Cu2+。
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,即石墨是阴极,所以铁是阳极,M是电源的正极,则铁电极的方程式是Fe-2e-=Fe2+。
②乙烧杯电解硫酸铜溶液,石墨为阳极,铜是阴极,所以电解的总方程式是2CuSO4+2H2O
 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为0.64g÷64g/mol =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol
根据甲烧杯产生气体的电极反应可知
2H++2e-=H2↑
2mol 22.4L
0.02mol V
所以V=0.224L。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,侧重考查学生分析问题、解决问题的能力。做题时要注意电极的判断和电极反应的书写,注意串联电路中各电极转移的电子数目相等,利用反应的方程式计算即可。

练习册系列答案
相关题目


 。
。 Fe2O3?x H2O),写出铁发生电化学腐蚀时负极的电极反应:____________________________________________ 。
Fe2O3?x H2O),写出铁发生电化学腐蚀时负极的电极反应:____________________________________________ 。