题目内容
1. A、B、C、D、E为原子序数依次增大的短周期元素.A、C处于同一主族,C、D、E处于同一周期;A、B组成的气体X能使湿润的红色石蕊试纸变蓝.C在短周期元素中金属性最强,E原子的最外层电子数是A、B、C原子最外层电子数之和,E的单质与x反应能生成溶于水呈强酸性的化合物Z,同时生成B的单质,D的单质既能与C的最高价氧化物的水溶液反应,也能与Z的水溶液反应;C、E可组成化合物M.
A、B、C、D、E为原子序数依次增大的短周期元素.A、C处于同一主族,C、D、E处于同一周期;A、B组成的气体X能使湿润的红色石蕊试纸变蓝.C在短周期元素中金属性最强,E原子的最外层电子数是A、B、C原子最外层电子数之和,E的单质与x反应能生成溶于水呈强酸性的化合物Z,同时生成B的单质,D的单质既能与C的最高价氧化物的水溶液反应,也能与Z的水溶液反应;C、E可组成化合物M.(1)E离子的结构示意图
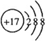 .
.(2)写出X的电子式
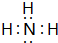 ;
;(3)写出D的单质与C元素最高价氧化物的水化物在水溶液中反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)E的单质与X反应中氧化剂与还原剂的物质的量之比3:2;
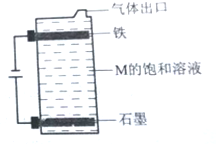
(5)按图电解M的饱和溶液,石墨电极上发生反应的离子方程式为2Cl--2e-=Cl2↑,电解时装置内发生反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑、Cl2+2NaOH=NaCl+NaClO+H2O.
分析 A、B、C、D、E为原子序数依次增大的短周期元素.A、B组成的气体X能使湿润的红色石蕊试纸变蓝,则X为NH3,A为H元素,B为N元素;A、C处于同一主族,C在短周期元素中金属性最强,C的原子序数大于氮,故C为Na;C、D、E处于同一周期,即处于第三周期,E原子的最外层电子数是A、B、C原子最外层电子数之和,则E原子最外层电子数为1+1+5=7,故E为Cl,E的单质与X反应能生成溶于水呈强酸性的化合物Z,同时生成B的单质,应是氯气与氨气反应生成氮气与HCl,D的单质既能与C的最高价氧化物的水溶液反应,也能与Z的水溶液反应,则D为Al;C、E可组成化合物M为NaCl,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的短周期元素.A、B组成的气体X能使湿润的红色石蕊试纸变蓝,则X为NH3,A为H元素,B为N元素;A、C处于同一主族,C在短周期元素中金属性最强,C的原子序数大于氮,故C为Na;C、D、E处于同一周期,即处于第三周期,E原子的最外层电子数是A、B、C原子最外层电子数之和,则E原子最外层电子数为1+1+5=7,故E为Cl,E的单质与X反应能生成溶于水呈强酸性的化合物Z,同时生成B的单质,应是氯气与氨气反应生成氮气与HCl,D的单质既能与C的最高价氧化物的水溶液反应,也能与Z的水溶液反应,则D为Al;C、E可组成化合物M为NaCl,.
(1)Cl-离子的结构示意图为: ,故答案为:
,故答案为: ;
;
(2)X为NH3,其电子式为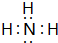 ,故答案为:
,故答案为: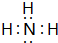 ;
;
(3)Al与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)E的单质与X反应为:3Cl2+2NH3=N2+6HCl,反应中氧化剂为氯气,还原剂为氨气,氧化剂与还原剂的物质的量之比为3:2,故答案为:3:2;
(5)电解NaCl的饱和溶液,石墨电极为阳极,发生氧化反应,氯离子失去电子生成氯气,阳极发生反应的离子方程式为:2Cl--2e-=Cl2↑;电解时装置内发生反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:2Cl--2e-=Cl2↑;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查结构性质位置关系综合应用,侧重对化学用语的考查,推断元素是解题关键,注意对基础知识的理解掌握.

 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( ) | 组别 | 对应曲线 | c(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度大于2.5 mol•L-1 | |
| C. | 第2组实验中盐酸的浓度等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度低于30℃ |
| A. | 相对原子质量和核外电子数 | B. | 电子层数和最外层电子数 | ||
| C. | 相对原子质量和最外层电子数 | D. | 电子层数和次外层电子数 |
| A. | 凡是物质的化学变化都伴随着能量的变化 | |
| B. | 凡是伴随能量变化的都是化学变化 | |
| C. | 凡是放热反应都需要加热 | |
| D. | 凡是放热反应都不需要加热 |
| A. | 正丁烷 | B. | 异丁烷 | C. | 甲烷 | D. | 丙烷 |
| A. | 所含共用电子对数为($\frac{a}{7}+1$)NA | B. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | ||
| C. | 燃烧时消耗的O2一定是$\frac{33.6a}{14}$L | D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
| A. | 此元素有三种同位素 | |
| B. | 其中质量数为79的同位素原子占原子总数 $\frac{1}{2}$ | |
| C. | 其中一种同位素质量数为80 | |
| D. | 此元素单质的平均相对分子质量为160 |

 .
.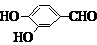 、
、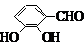 、
、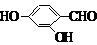 、
、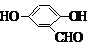 (其中三种)(写出3种).
(其中三种)(写出3种).