题目内容
【题目】氯碱工业中电解饱和食盐水的原理示意图如图:
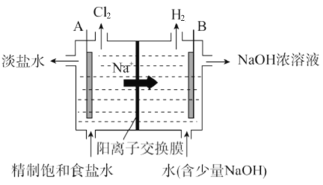
(1)电极 A 是_________(填“阴极”或“阳极”),判断依据为_________。
(2)写出电极 B 的电极反应式_________。
(3)写出电解饱和食盐水的化学方程式_________。
(4)一段时间后,电极 B 周围 NaOH 稀溶液转变为浓溶液,原因:_________。
(5)电解时,工业用盐酸调节 A 室的 pH=2~3,请用化学平衡原理解释原因_________。
【答案】阳极 阳极发生氧化反应 ![]()
![]() 电极B是阴极,产生OH-,Na+从左侧进入右侧,故NaOH浓度增大 溶液中存在化学平衡
电极B是阴极,产生OH-,Na+从左侧进入右侧,故NaOH浓度增大 溶液中存在化学平衡![]() ,调节pH为2~3,使平衡逆向移动,减少氯气的损失
,调节pH为2~3,使平衡逆向移动,减少氯气的损失
【解析】
(1)电极A 发生![]() ,化合价升高,发生氧化反应,故是阳极,判断依据为阳极发生氧化反应,故答案为:阳极 阳极发生氧化反应;
,化合价升高,发生氧化反应,故是阳极,判断依据为阳极发生氧化反应,故答案为:阳极 阳极发生氧化反应;
(2)电极B为阴极,电极反应式![]() ,故答案为:
,故答案为:![]()
(3)从装置图中根据物质的进出分析可知电解饱和食盐水的化学方程式![]() ,故答案为:
,故答案为:![]()
(4)一段时间后,电极B为阴极,产生大量的OH-,左侧的Na+则可以透过阳离子交换膜进入右侧,故电极B周围 NaOH 稀溶液转变为浓溶液,故答案为:电极B是阴极,产生OH-,Na+从左侧进入右侧,故NaOH浓度增大;
(5)因为氯气能溶于水,溶于水的部分氯气与水反应存在化学平衡![]() ,电解时,工业用盐酸调节 A 室的 pH=2~3,是通过增大H+和Cl-浓度来使平衡逆向移动,减小氯气的损失,故答案为:溶液中存在化学平衡
,电解时,工业用盐酸调节 A 室的 pH=2~3,是通过增大H+和Cl-浓度来使平衡逆向移动,减小氯气的损失,故答案为:溶液中存在化学平衡![]() ,调节pH为2~3,使平衡逆向移动,减少氯气的损失。
,调节pH为2~3,使平衡逆向移动,减少氯气的损失。

 名校课堂系列答案
名校课堂系列答案【题目】![]() 与
与![]() 催化重整反应为
催化重整反应为![]()
![]() 。现向
。现向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 进行催化重整反应,不同温度下平衡体系中
进行催化重整反应,不同温度下平衡体系中![]() 和CO的体积分数
和CO的体积分数![]() 随温度变化如下表所示:
随温度变化如下表所示:
体积分数 温度 |
|
|
| a | a |
| c | b |
测得:![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
A.![]() 大于
大于![]()
B.![]() 时该反应的平衡常数为
时该反应的平衡常数为![]()
C.![]() 时向
时向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 进行催化重整反应,达到平衡时,
进行催化重整反应,达到平衡时,![]() 为
为![]()
D.![]() 时向
时向![]() 恒容密闭容器中充入等物质的量
恒容密闭容器中充入等物质的量![]() 、
、![]() 、CO、
、CO、![]() 进行催化重整反应,此时反应可能正向移动
进行催化重整反应,此时反应可能正向移动
【题目】一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)A(s)+B(g)![]() C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
Ⅲ | 0.32 | 1.0 | 0 | 0 | |
Ⅳ | 0.12 | 0.30 | v(正)=v(逆) |
下列说法正确的是
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ
D.容器Ⅳ中c(D)= 0.4 mol·L-1