题目内容
【题目】常温下,有 0.1 mol/L 的四种溶液:①HCl ②CH3COOH ③NaOH ④Na2CO3
(1)用化学用语解释溶液①呈酸性的原因:_________。
(2)溶液③的 pH=_________。
(3)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①_________②(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:_________。
(5)常温下,下列关于溶液②的判断正确的是_________。
a.c(CH3COO) = 0.1 mol/L
b.溶液中c(H+) > c(CH3COO) > c(OH )
c.加入CH3COONa(s),c(H+)不变
d.滴入 NaOH 浓溶液,溶液导电性增强
【答案】HCl=H+ + Cl- 13 = 溶液中存在![]() ,水解为吸热反应,加热使平衡正向移动 bd
,水解为吸热反应,加热使平衡正向移动 bd
【解析】
(1)盐酸溶液呈酸性是由于HCl发生电离产生了H+,故答案为:HCl=H++ Cl-;
(2)0.1 mol/LNaOH溶液中,c(OH)=0.1mol/L,故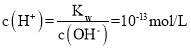 ,pH=13,故答案为:13;
,pH=13,故答案为:13;
(3)因为溶液①、②与溶液③都是按1:1进行反应的,故分别与等量的溶液③恰好完全反应,消耗的体积相等,故答案为:=;
(4)由溶液中存在![]() ,加热使平衡正向移动,故碱性增强,故答案为:溶液中存在
,加热使平衡正向移动,故碱性增强,故答案为:溶液中存在![]() ,水解为吸热反应,加热使平衡正向移动
,水解为吸热反应,加热使平衡正向移动
(5)a.根据物料守恒有c(CH3COO)+c(CH3COOH)= 0.1 mol/L,故a错误;
b.溶液中有醋酸和水都会电离出H+,故c(H+) > c(CH3COO) > c(OH),故b正确;
c.加入CH3COONa(s),c(CH3COO)增大,使得醋酸的电离平衡逆向移动,c(H+)减小,故c错误;
d.醋酸是弱电解质,只能部分电离,滴入NaOH浓溶液后反应生成了强电解质醋酸钠,故溶液导电性增强,故d正确;
故答案为:bd。

【题目】![]() 时,向容积为2L的恒容密闭容器中充入一定量的CO和
时,向容积为2L的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() 。反应过程中测定的部分数据见下表:
。反应过程中测定的部分数据见下表:
反应时间 |
|
|
0 |
|
|
20 |
|
|
30 |
|
|
下列说法正确的是
A.反应在![]() 内的平均速率为
内的平均速率为![]()
B.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() 、
、![]() 、
、![]() ,达到新平衡前
,达到新平衡前![]() 正
正![]() 逆
逆![]()
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
【题目】I.NaHSO3、CuSO4为实验室常用的化学试剂,均易溶于水,且水溶液显酸性。在铁片镀铜实验中,为提高电镀效果,常用CuSO4溶液作为电镀液。装置如图所示,a接电源_____极,阳极的电极反应式为:_____。电镀过程中c(Cu2+)_____(填“基本不变”、“变大”或“变小”)。

II.某实验小组对NaHSO3溶液分别与CuSO4、CuCl2溶液的反应进行探究。
实验 | 装置 | 试剂x | 操作及现象 |
A |
| 1mol·L1CuSO4溶液 | 加入2mLCuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
B | 1mol·L1CuCl2溶液 | 加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
(1)推测实验B产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到_____,反应的离子方程式为_____。
(2)对实验B产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与HSO![]() 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是_____;
②实验表明假设b合理,实验B反应的离子方程式有_____、H++HSO![]() =SO2↑+H2O。
=SO2↑+H2O。
(3)对比实验A、B,提出假设:Cl-增强了Cu2+的氧化性。下述实验C证实了假设合理,装置如图(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_____________________________________(补全实验操作及现象)。

(4)将实验A的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO![]() 。已知:
。已知:
I.![]() ;
;
II.
III.Cu2O是一种红色粉末状固体,几乎不溶于水,但溶于氨水,成稳定的、无色的配合物[Cu(NH3)2]+。
①通过实验D证实红色沉淀中含有Cu+和Cu2+。
实验D:
证实红色沉淀中含有Cu+的实验证据是_____;
②有同学认为实验D不足以证实红色沉淀中含有Cu2+,设计实验D的对比实验E,证实了Cu2+的存在。实验E的方案和现象是_____。(要求:用图示表示,参照实验D)