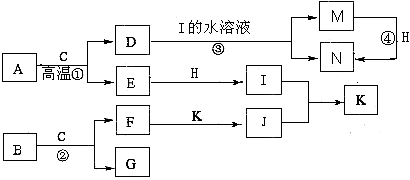
题目内容
中学常见反应的化学方程式是:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,该反应的离子方程式是 。
(2)若A为常见的非金属单质,B的溶液为某浓酸,其氧化产物的结构式为 ______
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是 (填所在周期和族)
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,被还原的X
是 mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
(1)MnO2+4H++2Cl-(浓) Mn2++Cl2↑+2H2O (2分)(2)O=C=O (1分)
Mn2++Cl2↑+2H2O (2分)(2)O=C=O (1分)
(3)①第4周期第Ⅷ族(1分)②0.4a(2分)(4)NaAlO2 NaCl(2分)
解析试题分析:(1)A+B→X+Y+H2O,其中A、B的物质的量之比为1:4。若Y是黄绿色气体,则Y一定是Cl2,因此该反应是实验室制备氯气的反应,所以该反应的离子方程式为MnO2+4H++2Cl-(浓) Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)若A为常见的非金属单质,B的溶液为某浓酸,其氧化产物的结构式为,则符合条件的是碳和浓硝酸反应生成CO2、NO2和水,反应的化学方程式C+4HNO3(浓) CO2↑+4NO2↑+2H2O,其中碳是还原剂,因此氧化产物是CO2,CO2含有碳氧双键,其结构式为O=C=O。
CO2↑+4NO2↑+2H2O,其中碳是还原剂,因此氧化产物是CO2,CO2含有碳氧双键,其结构式为O=C=O。
(3)①若A为金属单质,常温下A在B的浓溶液中“钝化”,因此A是铁或铝。又因为A可溶于X溶液中,这说明A应该是变价金属铁,即A是铁,位于元素周期表的第4周期第Ⅷ族。
②X与铁反应的离子方程式为Fe + 2Fe3+=3Fe2+,
1mol 2mol 3mol
n 2n 3n
则根据含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等可知
a-2n=3n,解得n=0.2x,所以被还原的X是0.4amol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,说明A中含有氯离子;B的焰色为黄色,说明B中含有钠离子,因此符合条件的是氯化铝与氢氧化钠的反应。若A与B按物质的量之比1:4反应后,则反应的化学方程式为AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,所以溶液中溶质的化学式为NaAlO2、NaCl。
考点:考查无机物推断的有关判断

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案下列说法不正确的是( )
①Al2O3用作耐火材料、Al(OH)3用作阻燃剂
②硫粉在过量的纯氧中燃烧可以生成SO3
③少量SO2通过浓的CaCl2溶液能生成白色沉淀
④工业上生产水泥和玻璃均用到的原料是石灰石
⑤在工业生产中用银和浓硝酸反应制取硝酸银
⑥工业上常用硅制造光导纤维
⑦镁的冶炼: 
⑧用热的纯碱溶液清洗油污:
⑨用氢氟酸刻蚀玻璃:4HF+SiO2=SiF4↑+2H2O
⑩自然界中不存在游离态的硅,硅主要以二氧化硅和硅酸盐的形式存在
| A.②③⑤⑥⑧ | B.①③⑥⑨ | C.④⑤⑨⑩ | D.②③⑥⑦ |
化学与科学、技术、社会、环境、生活等密切相关。下列有关说法中错误的是
| A.液氨可用作制冷剂 |
| B.小苏打用于治疗胃酸过多 |
| C.明矾可用于自来水的杀菌消毒 |
| D.硅酸钠用于制备硅胶和木材防火剂的原料 |


 的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的
的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的
 (3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);