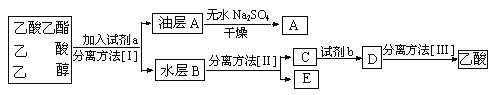
题目内容
【题目】现有①、②、③、④四种元素的基态原子的电子排布式如下:①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() 。则下列有关比较中不正确的是
。则下列有关比较中不正确的是
A.电负性:④>③>②>①
B.最高正化合价:③>②>①>④
C.原子半径:①>②>③>④
D.第一电离能:④>③>②>①
【答案】D
【解析】
本题考查原子半径、第一电离能、电负性、最高正价的比较,运用元素周期律和元素电离能、电负性规律分析。
①、②、③、④四种元素的基态原子的电子排布式如下:①![]() ; ②
; ②![]() ;③
;③![]() ;④
;④![]() ,在原子中原子核外电子数
,在原子中原子核外电子数![]() 核内质子数
核内质子数![]() 原子序数,根据原子核外电子排布式知,①②③④原子序数分别是12、13、7、8,所以分别是Mg、Al、N、O元素;
原子序数,根据原子核外电子排布式知,①②③④原子序数分别是12、13、7、8,所以分别是Mg、Al、N、O元素;
A.元素的非金属性越强,其电负性越大,金属性越强,电负性越小,金属性![]() ,非金属性
,非金属性![]() ,则电负性:④>③>②>①,故A正确;
,则电负性:④>③>②>①,故A正确;
B.主族元素的最高正化合价等于主族族序数![]() 、F元素除外
、F元素除外![]() ,O元素没有正化合价,所以其最高正化合价为:③>②>①>④,故B正确;
,O元素没有正化合价,所以其最高正化合价为:③>②>①>④,故B正确;
C.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径:①>②>③>④,故C正确;
D.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,其第一电离能随着原子序数增大而减小,所以第一电离能:③>④>①>②, 故D错误;
答案选D。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案【题目】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的 HCN 气体,同时 HCN 又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
下列选项错误的是( )
A.向NaCN溶液中通入少量CO2发生的离子反应为2CN-+H2O+CO2=2HCN+![]()
B.相同浓度的 HCOOH和NaCN 的溶液中,水的电离程度前者小
C.中和等体积、等pH 的 HCOOH 溶液和 HCN 溶液消耗 NaOH 的物质的量前者小于后者
D.等体积、等物质的量浓度的 HCOONa 和 NaCN 溶液中所含离子总数前者大于后者